
近日,北京大学药学院天然药物及仿生药物全国重点实验室谢海燕教授团队在Cell Reports Medicine杂志发表了题为“Potentiating immunotherapy in ‘immune-cold’ solid tumors through orchestrating T cell immunity via tumor-specific genetic engineering”的研究论文。该研究开发了一种肿瘤特异性的基因工程化表达系统,通过全方位重塑T细胞抗肿瘤免疫应答,实现对多种低免疫原性“冷肿瘤”的高效抑制,并显著提升免疫检查点抑制剂(ICIs)和嵌合抗原受体T细胞(CAR-T)疗法对实体瘤的治疗效果。

过继性T细胞和免疫检查点阻断等免疫治疗策略旨在提高瘤内T细胞的数量及功能活性,从而增强细胞毒性T细胞的抗肿瘤免疫效能。然而,T细胞对于实体瘤的治疗仍面临严峻挑战。例如,致密的肿瘤基质阻碍T细胞的迁移与浸润;免疫抑制性肿瘤微环境削弱T细胞的存活能力和增殖潜能;肿瘤细胞固有的免疫逃逸机制降低T细胞的细胞毒性,等等。因此,T细胞介导的免疫疗法临床获益仍非常有限,尤其是在免疫原性低的“冷肿瘤”患者中。
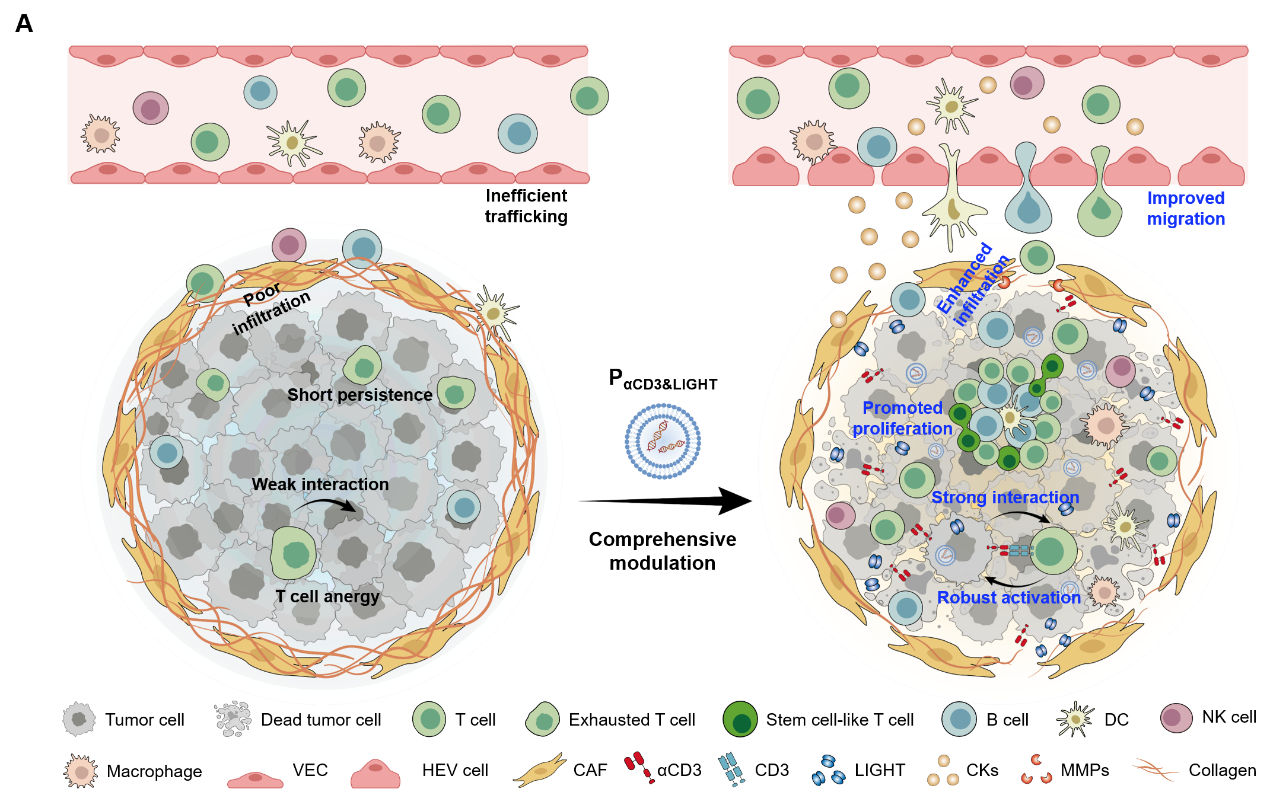
鉴于此,谢海燕教授团队设计开发了由肿瘤细胞特异性启动子(pTERT)驱动的双表达质粒系统(PαCD3&LIGHT),实现了肿瘤细胞内肿瘤坏死因子超家族成员14(LIGHT)的高效分泌及抗CD3单链抗体-B7融合蛋白(αCD3)的肿瘤细胞膜定位表达。其中,LIGHT诱导瘤内趋化因子和血管内皮粘附分子的高效表达,并促进高内皮微静脉(HEVs)的形成,进而促进T细胞向肿瘤部位的定向迁移;同时,LIGHT通过双重调控机制实现肿瘤细胞外基质(ECM)重构,有效破坏肿瘤边界致密胶原屏障,驱动多种免疫细胞向肿瘤实质区的深度浸润。进而,在关键趋化因子(如CXCL13/CCL19)诱导下,浸润的淋巴细胞自组织形成三级淋巴样结构(TLSs),显著增强瘤内干细胞样T细胞的自我更新与增殖能力。另一方面,肿瘤细胞表面锚定的αCD3通过桥接瘤内T细胞,持续活化并逆转其耗竭状态,促进T细胞毒性因子(如IFN-γ、TNF-α、颗粒酶)的靶向释放,进而高效诱导肿瘤细胞凋亡。在荷瘤小鼠模型中,该策略有效抑制了鼠B16黑色素瘤、CT26结肠癌、4T1乳腺癌三种低免疫原性“冷肿瘤”的生长,并显著增强了ICIs和CAR-T细胞的抗肿瘤效能。而且,该研究还构建了人源共表达系统,通过双重协同机制显著提升了人源CAR-T细胞的抑瘤效果,为推进实体瘤免疫治疗临床治疗提供了新的策略和实证支持。
北京大学药学院、天然药物及仿生药物全国重点实验室谢海燕教授和北京理工大学生命学院聂伟东副教授为本文的通讯作者。北京理工大学博士生何佳奇为论文的第一作者。该研究获得国家自然科学杰出青年基金、国家自然科学重大项目等项目的支持。
论文链接:https://doi.org/10.1016/j.xcrm.2025.102510
作者简介:

谢海燕,北京大学博雅特聘教授,博士生导师,国家自然科学杰出青年基金、优秀青年科学基金获得者,教育部“新世纪优秀人才支持计划”和北京市“优秀人才资助计划”入选者,英国皇家化学会会士,中国生物材料学会理事,中国分析测试协会分析药学分会副主任委员,Smart Molecules编委,New Journal of Chemistry顾问委员。先后主持国家自然科学重大项目课题、国家重大科学研究计划(973)项目课题等科研项目16项。在Nat. Biomed. Eng., Nat. Common., Sci. Adv.等刊物发表SCI收录论文百余篇;申请国家发明专利14项,并已授权转化2项,其中1项已投入大批量生产;获省部级自然科学一等奖1项、技术发明特等奖1项。
天然药物及仿生药物全国重点实验室 供稿