

2021年9月7日,北京大学药学院天然药物及仿生药物国家重点实验室马明研究团队在美国化学会《ACS Catalysis》上发表了题为“Functional characterization and crystal structure of the bifunctional thioesterase catalyzing epimerization and cyclization in skyllamycin biosynthesis”的研究论文。该研究发现了环肽分子生物合成中第一个催化异构化和环化的双功能硫酯酶,解析其晶体结构并阐明了其活性位点关键残基。
D构型氨基酸不是蛋白质的组成成分,但在天然肽类小分子中却是重要的结构单元。尤其在非核糖体肽类天然产物中,D构型氨基酸是其生物合成中的特征原料砌块(building block)。D构型氨基酸的存在不仅可以提供对蛋白酶水解的抗性、提供生物合成时序控制所需的立体结构限制,而且有的对化合物的生物活性至关重要。
在非核糖体肽生物合成中,自然界已经进化出几种酶来引入D构型氨基酸。而与这些已知的酶不同,马明研究团队发现了一个催化异构化和环化双功能的硫酯酶Skyxy-TE,该酶能产生含有D构型氨基酸残基的环肽分子。研究团队首先从一株海洋链霉菌Streptomyces sp. PKU-MA01239(来自于课题组构建的海洋细菌菌种库)中发现了非核糖体肽skyllamycin B,该类化合物为含有11个氨基酸残基的环肽分子,具有血小板生长因子抑制活性和抗生物膜活性。通过对Streptomyces sp. PKU-MA01239基因组测序确定了skyllamycin B的生物合成基因簇。Skyllamycin B中含有1个D构型羟基取代亮氨酸,推测其来自于非核糖体肽合成酶(NRPS)装配线最后一个硫酯酶功能域Skyxy-TE的催化。体外酶催化表明Skyxy-TE可以将链状底物类似物(来自于固相多肽合成)C末端L-亮氨酸残基异构化为D-亮氨酸,继而催化分子内环化反应形成环肽产物。有意思的是如果把底物类似物C末端的L-亮氨酸换成L-丙氨酸(侧链只含有一个甲基),Skyxy-TE仍然可以催化L-丙氨酸的异构化产生含有D-丙氨酸的环化产物。
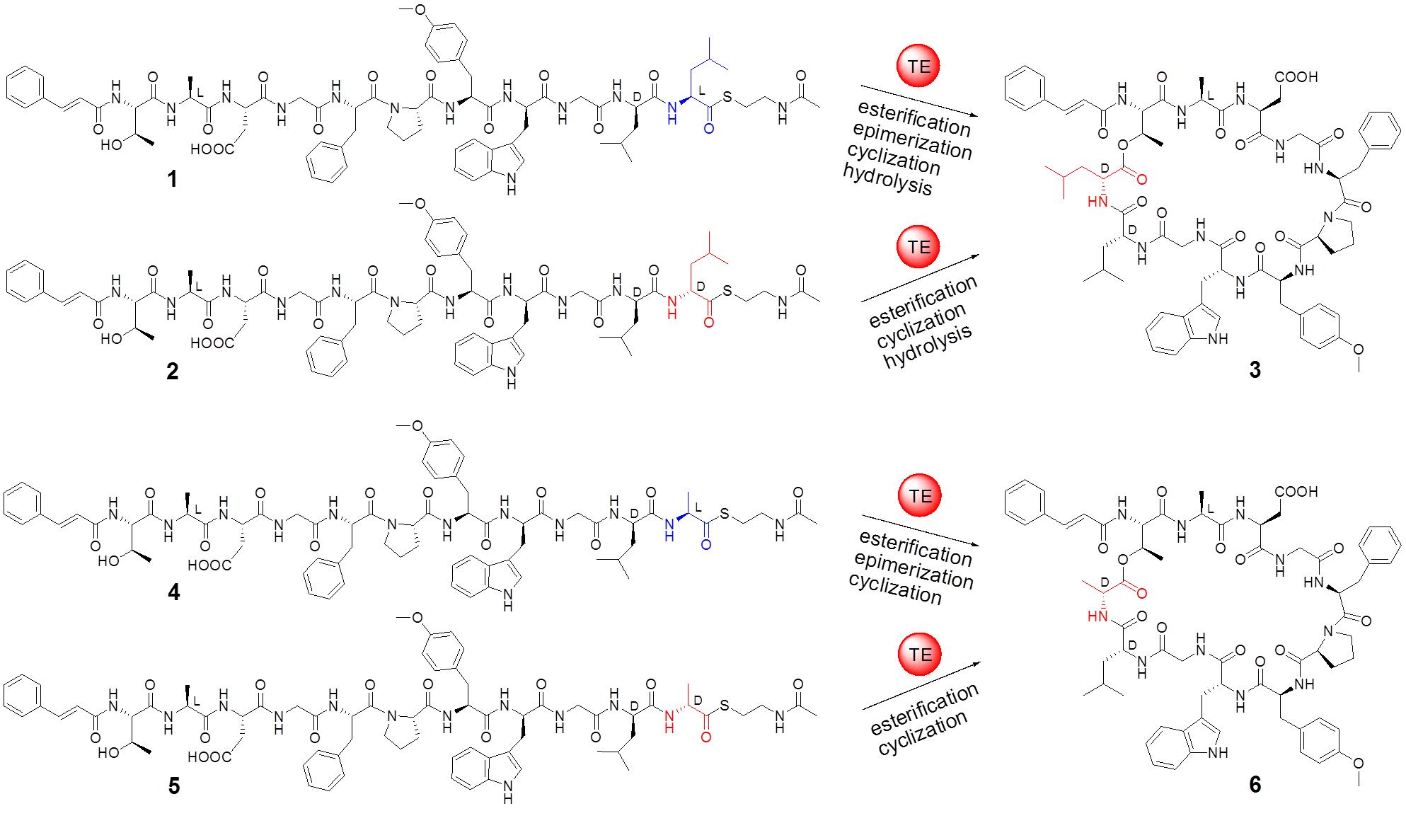
图1. 硫酯酶Skyxy-TE催化的异构化/环化反应
研究团队进而解析了Skyxy-TE的2.25埃分辨率的晶体结构,发现Skyxy-TE具有特异的活性中心,其活性中心由于两个残基(Q125和F202)的存在,使其比目前已知7个NRPS硫酯酶(I型)结构具有更狭窄的活性位点。点突变及体外酶催化表明Skyxy-TE-Q125A突变体失去了异构化的立体选择性,产生了没有异构化的含有L-亮氨酸残基的环化产物;而Skyxy-TE-F202A突变体则基本丧失了环化功能,产生了水解链状产物。
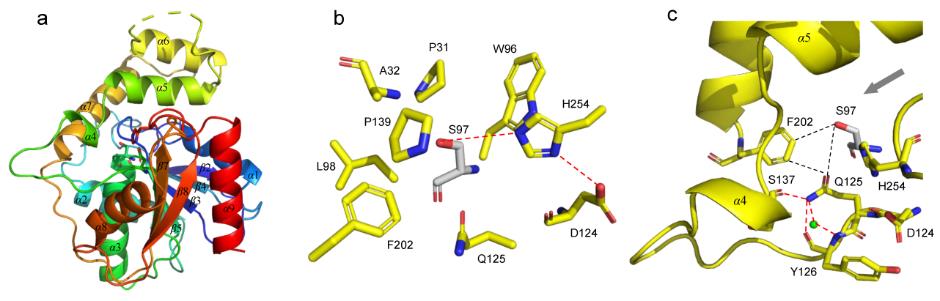
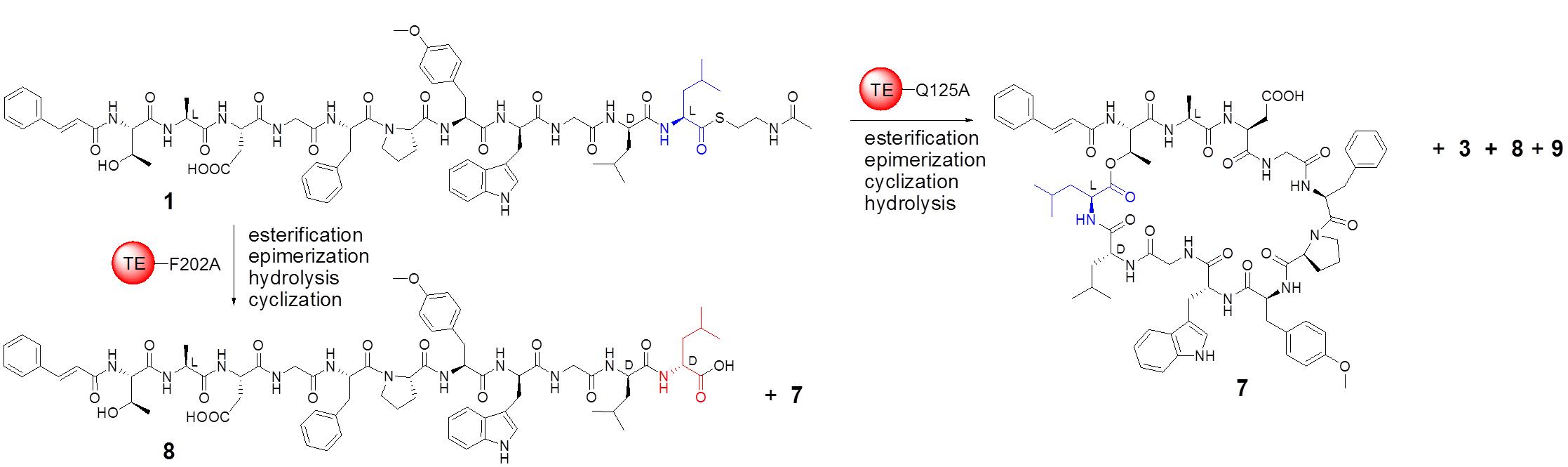
图2. 硫酯酶Skyxy-TE的晶体结构、活性位点以及突变体催化的反应
硫酯酶功能域催化环化或者水解反应已经很早就得到了充分阐明,本研究对Skyxy-TE异构化/环化的功能的表征进一步扩展了非核糖体肽合成酶(NRPS)“多才多艺”的认识。同时本研究对Skyxy-TE晶体结构的解析和关键残基的阐明有利于该酶在化学-酶联催化方面的应用,以进行D或L构型控制的多种环肽分子的制备。
该项工作得到科技部重点研发计划“深海关键技术与装备”项目“重要深海药源天然产物合成生物学产生体系构建”、国家自然科学基金委等资助。北京大学药学院博士后于佳慧、博士生宋娟为本论文共同第一作者,北京大学药学院马明研究员为通讯作者。感谢北京大学药学院林文翰教授在海洋天然产物研究和菌种库构建方面的长期支持,感谢董甦伟研究员在固相多肽合成、张亮仁教授在分子对接方面的支持!
第一作者:

原文链接:https://doi.org/10.1021/acscatal.1c03064
通讯作者简介:

马明,北京大学药学院、天然药物及仿生药物国家重点实验室研究员,博士生导师,Tenure-Track助理教授。研究领域为天然药用功能分子的生物合成,酶的三维结构及其催化机制,以及天然产物合成生物学。近5年以通讯作者在JACS、ACS Catal.、Chem. Sci.、Commun. Chem.、Org. Lett.、J. Biol. Chem.、J. Org. Chem.、J. Nat. Prod.、Chin. J. Chem.、Appl. Microbiol. Biotechnol.、ACS Omega、Mar. Drug等国际学术期刊发表论文10余篇。任中国药学会海洋药物专业委员会委员、中华中医药学会青年委员会委员、北京药学会天然药物专业委员会委员。
天然药物及仿生药物国家重点实验室 供稿