
核酸适体是通过体外筛选获得的,具有高亲和力、高选择性的寡核苷酸片段,通常被用作检测探针和疾病治疗。研究者们为了将核酸适体转化为药物分子进行了许多努力,但是能够阻断靶标相互作用的适体药物开发仍然面临着许多挑战。目前报道的功能适体的开发通常需要亲和适体的获取和功能筛选两步进行,这不仅耗时,而且亲和筛选可能缩小候选药物的范围。此外,适体通常需要繁琐的后修饰来克服药代动力学限制,这通常会影响适体与靶标的结合亲和力。

针对以上功能核酸适体药物开发的瓶颈问题,2024年8月21日,我院天然药物及仿生药物全国重点实验室张力勤研究员团队与合作者在Journal of the American Chemical Society杂志发表了题为 “Functional Aptamers In Vitro Evolution for Intranuclear Blockage of RNA-Protein Interaction”的研究论文。文章提出了一种新的功能核酸适体体外筛选平台(FAIVE),该平台将亲和适体获取与功能筛选相结合,并在此过程中引入化学多样性修饰。以HIV-1病毒细胞核内Tat蛋白和TAR RNA的RNA-蛋白相互作用为模型,利用FAIVE平台开发了具有显著细胞内阻断相互作用的功能性核酸适体。该研究还探索了脂质纳米颗粒递送系统,以提高细胞内递送效率,将核酸适体靶向潜力扩展到更广泛的细胞质和细胞核内区域。
研 究 内 容
1. 功能核酸适体体外筛选平台的建立
初始DNA文库由A、C、G以及C5-乙基-2′-脱氧-尿嘧啶(EdU)4种碱基组成,之后通过乳液PCR将预富集后的DNA文库制备成单克隆的适体微珠,利用“点击化学”反应将3-(2-叠氮基乙基)吲哚与EdU碱基上的乙基偶联,形成色氨酸侧链官能团,提高了文库的疏水性。在筛选过程中,使用荧光-淬灭对标记的TAR rna-Tat多肽复合物与适体微珠孵育,具有阻断作用的适体微珠能够破坏TAR RNA-Tat多肽复合物并恢复荧光,使用流式细胞分选仪对荧光微珠进行收集。随后,对收集的微珠进行扩增。经过几轮重复,具有阻断相互作用的适体序列被富集(图1)。
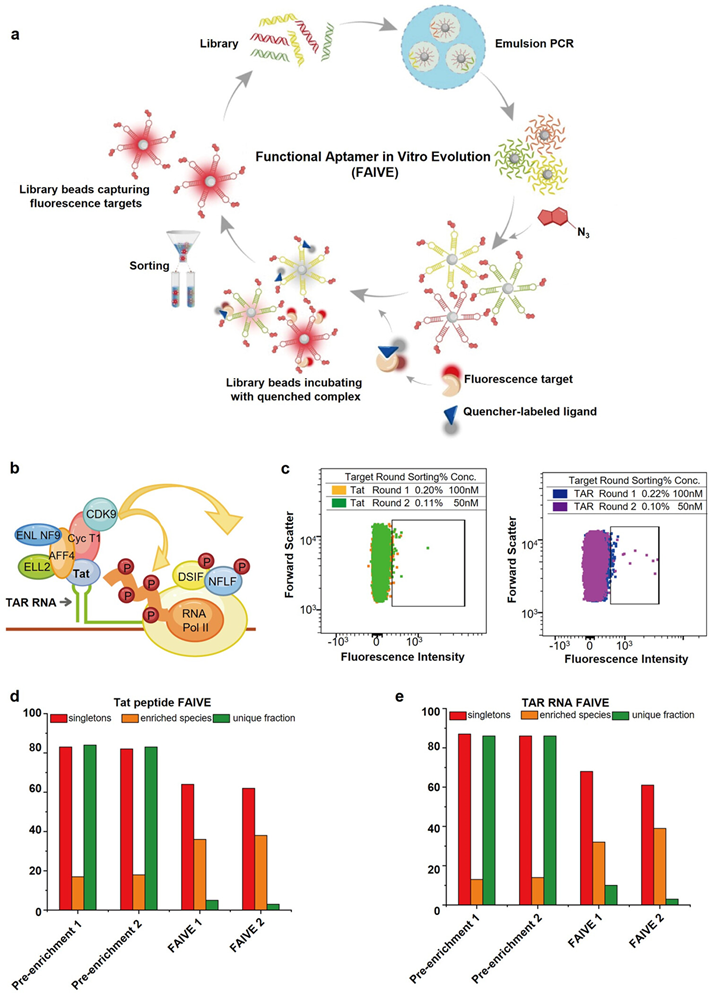
图1 阻断TAR RNA-Tat多肽相互作用的功能核酸适体体外进化(FAIVE)平台(图片选自文章)
2. 功能核酸适体性能评估
在用FAIVE平台进行功能化适体筛选的同时,研究者同时以TAR RNA和Tat蛋白为靶标,进行了基于亲和力的SELEX筛选。对筛选后序列进行分析,选取前96个簇中的序列进行适体的性能评估。通过BLI技术测定适体与相应靶标的结合亲和力,使用竞争取代分析测定适体的阻断作用。研究者发现,使用SELEX筛选得到的适体序列具有较好的结合亲和力,但具有阻断作用的功能核酸适体较少。而基于FAIVE平台得到的适体具有更优越的阻断作用,这显示了FAIVE平台强大的功能适体开发潜力(图2)。
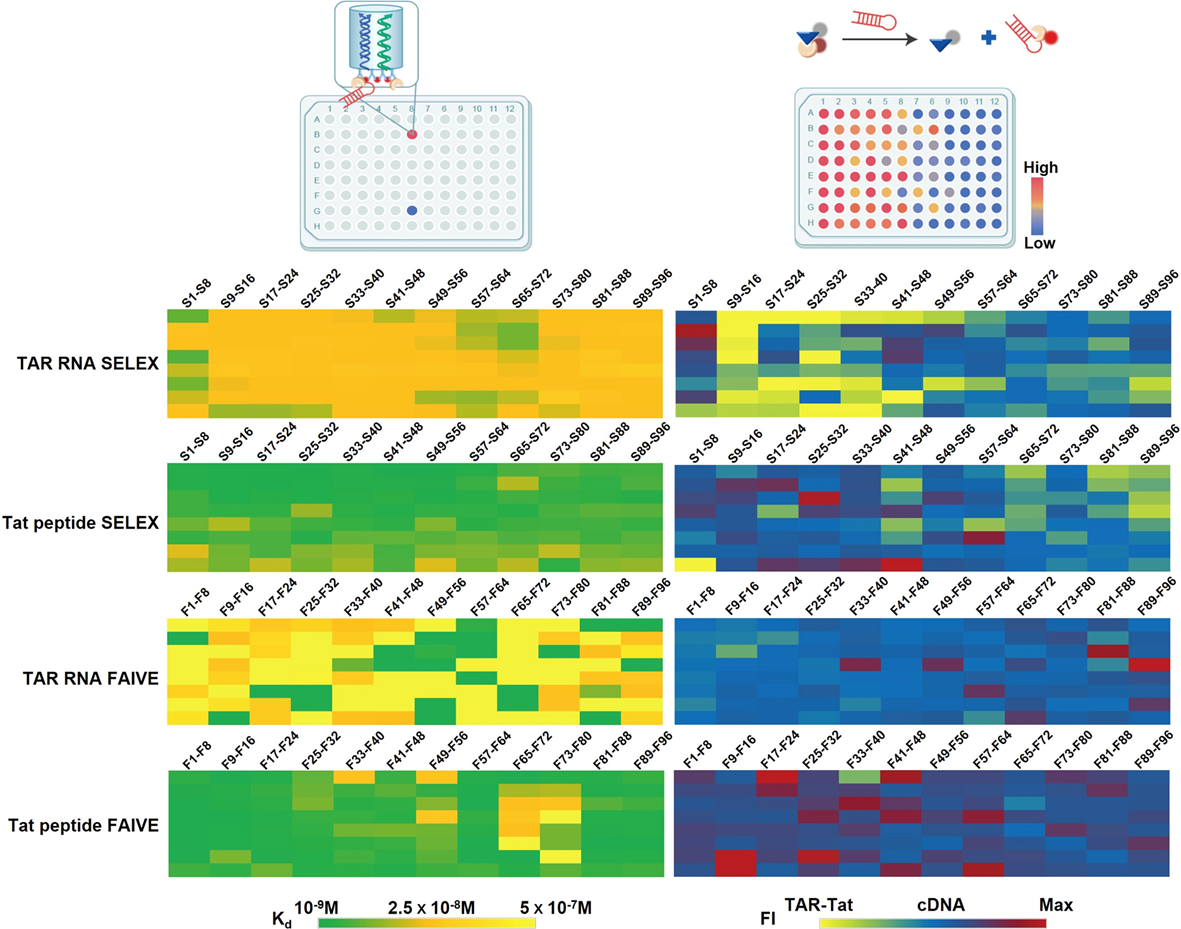
图2 核酸适体结合亲和力与阻断作用性能评估(图片选自文章)
3. 核酸适体递送体系的建立
为了评估适体药物的细胞内阻断效率,研究者采用中性胞苷脂材(DNCA)/阳离子脂材(CLD)脂质纳米颗粒进行适体的细胞内递送。DNCA作为一种有效的中性转染脂材,可以通过H键和π-π堆积与适体相互作用。CLD/DNCA的联合使用减少了CLD阳离子脂材的用量,降低了细胞毒性,并能提高适体的细胞内递送效率。最重要的是,脂质体纳米粒子的使用将核酸适体靶向潜力扩展到更广泛的细胞质和细胞核内区域(图3)。
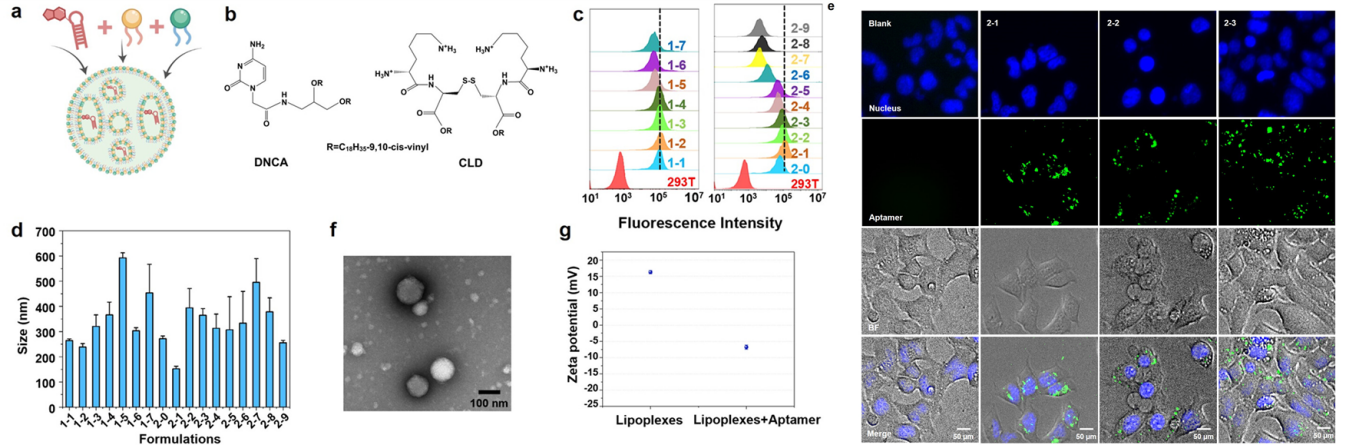
图3 核酸适体的脂质纳米颗粒递送系统(图片选自文章)
4. 功能核酸适体在细胞及假病毒中阻断作用的验证
研究者使用双萤光素酶报告基因模型系统探究候选适体是否能够调节细胞内TAR RNA-Tat蛋白的相互作用。在该系统中,TAR RNA与Tat蛋白的结合可以促进下游萤光素酶基因的转录,细胞产生的萤光素酶活性高低直接指示Tat蛋白的反式激活作用的强弱。研究发现候选适体的存在可以抑制细胞胞质内萤光素酶的表达,抑制率可以达到70%。然而在HIV-1病毒中,TAR RNA和Tat蛋白之间的相互作用仅发生在细胞核内,随后病毒整合到宿主细胞基因组并启动下游转录过程。因此,适体只有通过进入细胞核,成功阻断TAR RNA-Tat蛋白相互作用,才能发挥其抑制功能,从而阻止病毒感染。因此研究者使用VSVG/HIV-1假病毒模型评估所选适体在阻止细胞核内TAR RNA-Tat蛋白相互作用方面的功效。研究发现,测试的2条适体均能显示出10%至40%的剂量依赖性抑制率。这些结果证实了适体对TAR RNA-Tat蛋白相互作用的有效阻碍(图4)。
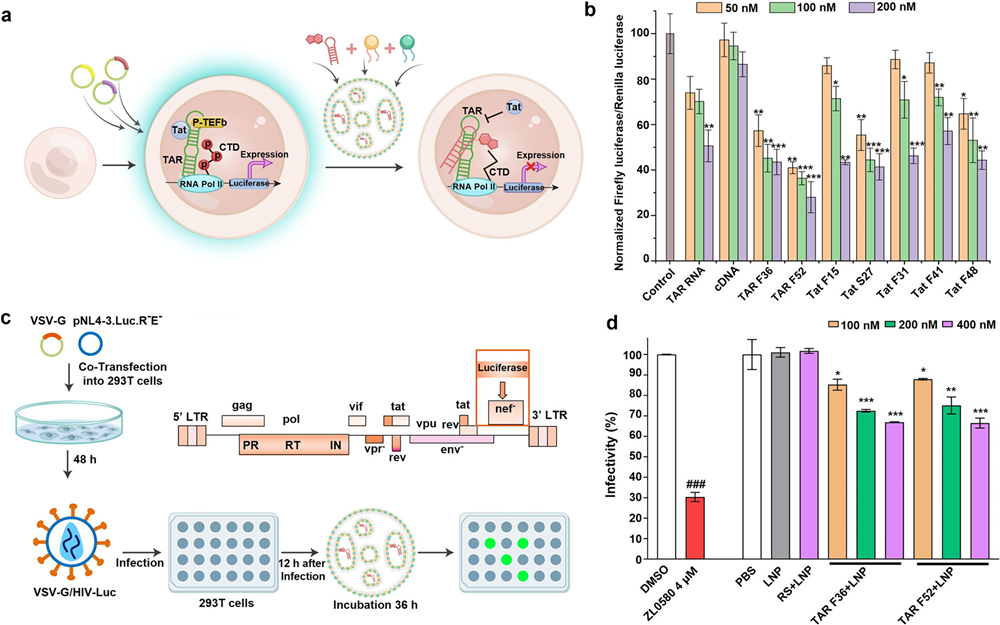
图4 候选适体在细胞及VSVG/HIV-1假病毒模型中阻断作用的验证(图片选自文章)
总 结
该研究建立了一个强大的体外筛选平台以促进功能核酸适体的发现,对于开发抑制大分子相互作用的核酸药物提供了一个成功案例。通过揭示适体与其指定靶标之间复杂的相互作用,这项工作将为适体筛选策略提供宝贵的见解。在脂质纳米颗粒等递送系统的不断完善下,潜在靶标范围的界限将被扩大,得以促进药物发现的快速发展。这一成就不仅有助于更深入地了解适体在细胞内的作用机制,而且为多种疾病的治疗带来了希望。
北京大学药学院的张力勤研究员、杨振军教授,陕西师范大学的张志琪教授,北京协和药物所的郭颖教授为论文的通讯作者。北京大学药学院博士后李俊为论文的第一作者,团队成员姚盼竹、赵旭洋、刘西洋、刘钦国、魏同萱、宣弘、卞思琪以及协和医学院的唐克博士为该研究做出了重要贡献。该研究获得国家重点研发计划、国家自然科学基金、医学科学创新基金等项目的支持。
论文链接:https://doi.org/10.1021/jacs.4c08824
第一作者简介

李俊,陕西师范大学博士,北京大学药学院博士后,获得国家博士后C类资助。以第一作者或共同作者身份在J. Am. Chem. Soc., Anal. Chem., Anal. Bioanal. Chem., ACS Sens., Sens. Actuators B Chem. 等杂志上发表多篇学术论文。研究方向为药物筛选模型和核酸适体药物功能化筛选。
张力勤研究员简介

张力勤, 博士,北京大学药学院助理教授、博士生导师,药物分析学系副主任,天然药物及仿生药物全国重点实验室研究员、课题组长。 2009年毕业于北大药学院本硕六年制药学专业, 2016年获得佛罗里达大学化学博士学位,曾在斯坦福大学医学院从事博士后研究工作,并在美国赛默飞世尔科技公司基因科学部担任高级科学家,2021年回国工作。主持基金委优秀青年基金、面上项目,科技部重点研发计划课题、参与基金委重大科研仪器研制项目。担任Science China Chemistry杂志青年编委。在Nat. Comm., J. Am. Chem. Soc., Angew. Chem. Int. Ed., 等顶级期刊上发表SCI研究论文超过 40 篇。研究方向聚焦于多元功能核酸分子工具的构建开发及其在药物筛选、生命分析和疾病诊疗中的应用。
杨振军教授简介

杨振军,北京大学医学部药学院教授,天然药物及仿生药物全国重点实验室PI。1987年获得北京医科大学药学专业学士学位,1998年在该校获药物化学专业理学博士学位, 2000-2002年在美国佐治亚大学药学院从事博士后研究, 2008年起任现职。曾任药物化学系副主任、国家自然科学基金委员会化学学部化学生物学流动项目主任,现任中国化学会化学生物学和中国药学会药物化学专业委员会委员。发表研究论文160多篇,申请和授权专利26项。负责科技部新药重大专项、973项目课题、重大863项目课题、自然基金委重点课题子课题和面上课题多项。曾获教育部自然科学一等奖1项、二等奖2项,国家自然科学二等奖1项。主要研究方向:1. 核酸药物的化学修饰和新型靶向制剂研究;2. 基于核酸适体的疾病早期检测新技术研究;3. 环核苷酸类信使分子化学生物学研究;4. 核苷类抗病毒药物研究。
天然药物及仿生药物全国重点实验室 供稿