
近日,学术期刊《Journal of the American Chemical Society》在线发表了我院天然药物及仿生药物国家重点实验室、化学生物学系董甦伟课题组题为“Probing N-Glycan Functions in Human Interleukin-17A Based on Chemically Synthesized Homogeneous Glycoforms”(基于化学合成均一糖型探究人白细胞介素-17A中N-糖链功能)的研究成果。
糖基化修饰对蛋白质的生物物理性质、生理病理功能等发挥着重要的调控作用,但糖链结构的多样性和异质性对阐明其结构-活性关系带来了巨大的挑战。与通常只能获取含不同糖链蛋白质混合物的生物表达方法相比,化学合成策略能够精准控制糖链结构,从而建立起特定蛋白质中糖基化修饰的构效关系,帮助我们获取蛋白质糖链功能的重要信息。
人白细胞介素-17A(IL-17A)是人体免疫系统中重要的糖蛋白类促炎细胞因子,与许多正常生理过程和多种自身免疫病的病理过程密切相关,也是缓解炎症反应、治疗自身免疫病的重要药物靶点。然而其糖基化修饰的功能尚不明确。由于成熟的IL-17A由两条单链共264个氨基酸组成,含有两个保守的N-糖基化修饰位点,分子量超过30 kDa,并且需要通过链内链间共6组二硫键正确配对形成相应的三级结构,这样复杂的分子要通过化学合成的方式得以构建难度极大。
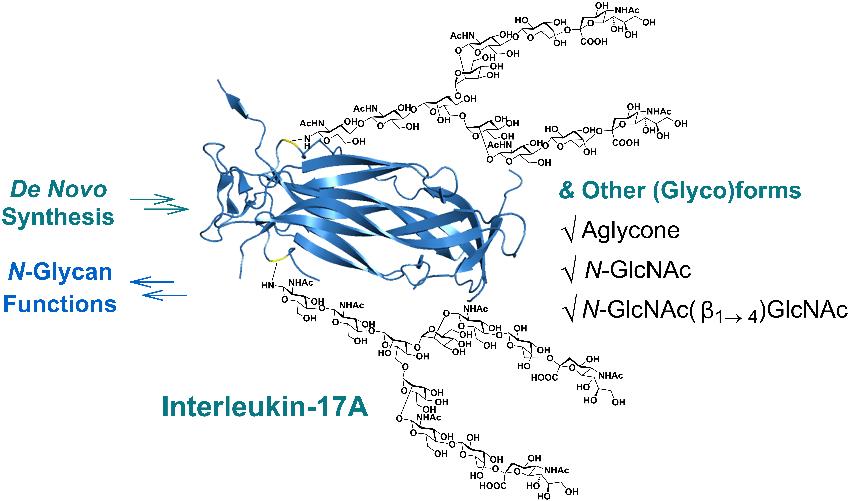
董甦伟团队设计和运用四片段收敛式合成的策略,基于固相多肽合成、多肽片段连接和无金属脱硫等方法,结合糖肽片段的化学-酶法糖链改造,以三次多肽片段连接、一次脱硫、一次半胱氨酸脱保护构建了糖基定点修饰的IL-17A单链;并经过大量的条件摸索和优化,成功实现了正确的折叠复性,合成出包括不含糖链修饰、以及分别含有单糖GlcNAc、二糖GlcNAc(β1→4)GlcNAc和复杂型双分支唾液酸化十一糖修饰,共四种形式的IL-17A。这也是迄今通过人工化学合成所得到分子量最大、二硫键体系最为复杂的N-糖修饰蛋白质。通过比对这一系列含有不同糖链结构的均质IL-17A分子,研究人员发现N-糖基化在IL-17A的体外重组折叠过程中发挥了抑制蛋白聚沉的作用,有利于提高获得正确构象的效率。体外生物活性评价和分子相互作用实验表明,大尺寸N-糖链不利于IL-17A与其受体的结合,暗示了该蛋白在体内发挥作用可能需要经历糖链剪切的过程,或者需要某些特定结构的糖链。这一工作表明在探究蛋白质糖基化翻译后修饰功能的相关研究中,化学合成方法能够发挥重要的作用;也提示了在未来进一步发展和运用高效的糖蛋白合成策略,将可能对相关生命科学领域的研究产生意义深远的影响。
该项研究获得国家自然科学基金优秀青年基金、科技部重点研发计划、北京市自然科学基金等项目资助。药学院博士研究生李红星、张俊,博士后安传敬合作完成了该项目,董甦伟研究员为该文通讯作者。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.0c12448
作者简介:

董甦伟,博士,北京大学研究员、博士生导师,药学院化学生物学系主任、天然药物及仿生药物国家重点实验室课题组长。入选国家海外高层次青年人才、北京市优秀青年人才。长期致力于蛋白质化学合成和糖基化功能研究、多肽及蛋白药物的合成及改造,以第一作者或通讯作者身份在Science、J. Am. Chem. Soc.、Adv. Sci.、Angew. Chem. Int. Ed.、Chem. Sci.等学术刊物发表多篇学术论文;作为负责人获国家自然科学基金优秀青年基金项目、北京市自然科学基金杰出青年基金项目等资助。先后获得中国国际多肽大会“青年多肽科学家奖”、“中国药学会-施维雅”青年药物化学奖等奖励。
天然药物及仿生药物国家重点实验室 供稿