
近日,我院天然药物及仿生药物全国重点实验室杨振军教授团队在国际权威期刊Journal of Controlled Release在线发表了题为“A Mannosylated peptidyl lipid CManDA doped into cytidinyl/cationic lipids efficiently delivers siG12Ss to lung cancer in vivo”的研究工作。

相较于小分子化药,核酸药物靶标广泛性且特异性高,有望解决“不可成药靶点”的药物开发难题。脂质纳米粒(LNP)是其主要递送系统,但毒性和肝脏蓄积问题严重。因此,开发一种安全高效的核酸药物靶向递送系统成为当前研究的迫切需求。
近些年来,杨振军团队开发了核苷酸脂材(DNCA等)/肽类阳离子脂材(CLD)的核酸药物包载体系(NLNP),实现了siRNA, ASO, mRNA, 环二核苷酸等体内安全有效递送。在肝外组织递送中,先期利用NLNP辅以DSPE-PEG-cRGD(R),经尾静脉注射(siG12D 1 mg/kg),显著提高了其小鼠原位胰腺癌的蓄积比例(由6%提升至18%),治疗效果显著(Biomed Pharmacother, 2024,博士研究生潘宇飞和博士后朱月洁为共同第一作者,杨振军教授为通讯作者)。
在上述研究工作基础上,杨振军团队进一步设计合成了一种新型甘露糖基化肽脂(CManDA),将其与DNCA和CLD组成混合包载体系D/50C/50M,包载2'-F/2'-OMe修饰的siG12S (M3)(DNCA/CLD/CManDA/M3=21: 15.8:15.8:1),纳米粒近中性(-2 mv),通过MM&MD及凝集素结合实验证实,甘露糖基暴露于纳米粒表面产生类PEG的电荷屏蔽效果。

图1 各组纳米粒蛋白冠情况分析。A. 不同组纳米粒表面结合蛋白的凝胶电泳图;B. 关键蛋白丰度比例;C. D/50C/50M/M3组前十位高丰度蛋白;D. D/C/M3组前十位高丰度蛋白;E. D/C/R/M3组前十位高丰度蛋白;F. 三组结合蛋白的等电点(pI)统计;G. 鉴定蛋白总数及高丰度蛋白占比;H. D/50C/50M/M3、D/C/M3与D/C/R/M3组蛋白冠总丰度对比;I. D/50C/50M/M3与D/C/M3组蛋白冠差异火山图
纳米粒进入体内血液循环后,血浆蛋白等会迅速与之结合形成蛋白冠。后者会重塑纳米粒与细胞之间的相互作用,可能会使其产生一定的器官(组织)靶向性。但对修饰有“靶头”的制剂是不利的,可能会屏蔽靶向基团。实验结果表明分布于纳米粒表面的甘露糖基对于血浆蛋白的结合同样具有屏蔽效果,D/50C/50M/M3与血浆蛋白结合量显著降低(5倍)。蛋白冠组成也明显发生改变,Alb结合比例(13.3%)显著提高,补体等调理蛋白结合降低,这有助于避免其被网状内皮系统(RES)识别清除,延长了纳米粒的循环时间并增强其肿瘤蓄积。值得注意的是,与已报道的LNP蛋白冠相比,D/C/M体系显著改变了脂质纳米粒蛋白冠组成。此外,既往研究认为纳米粒表面电性是影响蛋白吸附的关键因素,但D/50C/50M/M3、D/C/M3与D/C/R/M3组间结合蛋白的等电点(pI)无显著差异(图1),可能归因于NLNP独特的脂材结构及各组分配比。
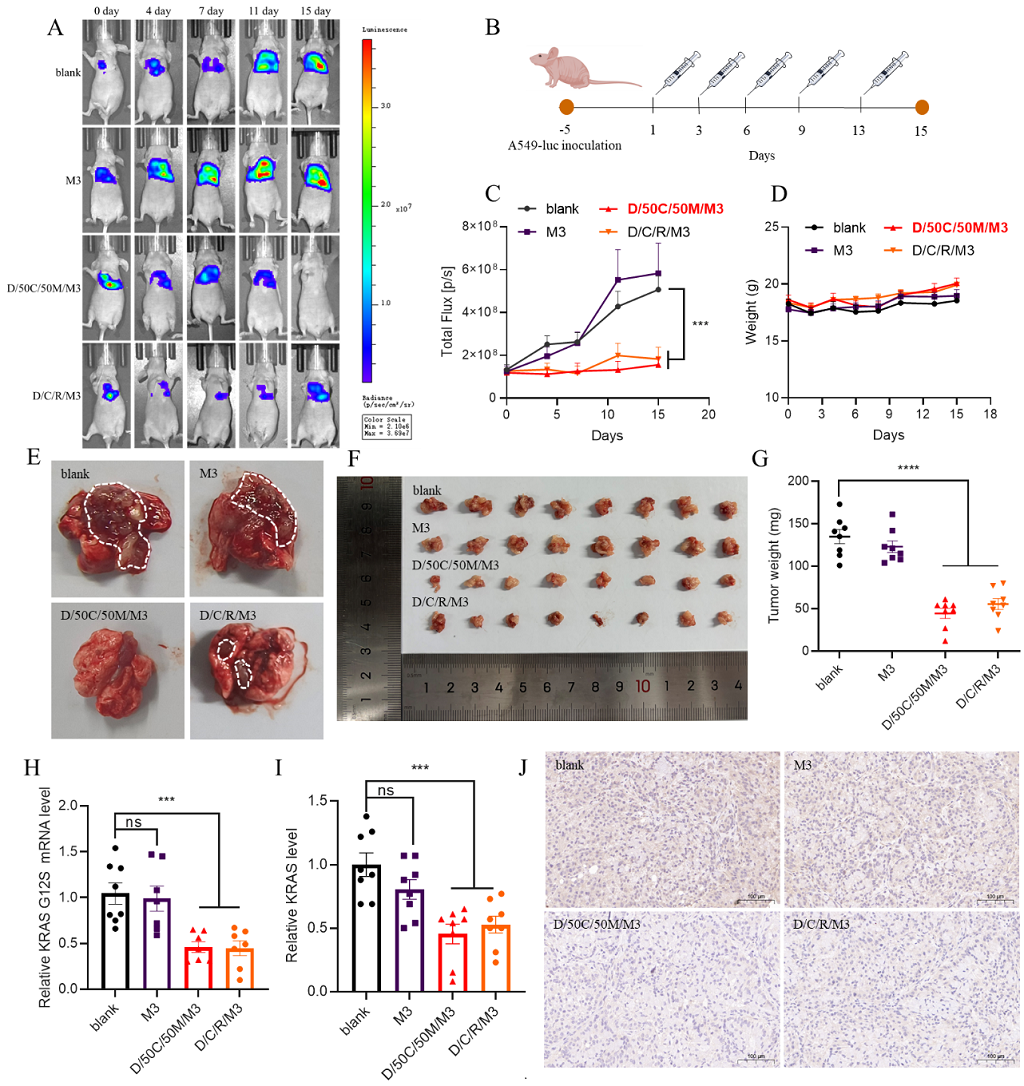
图2 D/50C/50M/M3在原位肺癌模型小鼠中的抗肿瘤疗效。A. 不同时间点各组生物发光强度对比;B. 治疗方案(剂量1.5 mg/kg,n=8);C. 肺癌模型小鼠生物发光强度增长曲线;D. 实验期间小鼠体重变化;E. 实验结束时各组肿瘤图像(白色虚线标记肿瘤边界);F. 各组肿瘤对比;G. 肿瘤重量统计;H. 肿瘤中KRASG12S mRNA表达水平;I. 肿瘤中KRAS蛋白表达量;J. 肿瘤切片免疫组化结果(蓝色:细胞核;棕色:KRAS蛋白)
通过上述的生物学过程,该系统能有效地将siRNA递送至肿瘤并抑制肿瘤发生发展。实验结果显示,D/50C/50M/Cy5.5-siG12S肿瘤部位荧光强度约为对照组的2.5倍。修饰物M3可延长其在靶组织中滞留时间,在小鼠原位肺癌模型中,D/50C/50M/M3药效显著(1.5 mg/kg, i.v.瘤重约为对照组的35%,沉默了KRASG12S的mRNA约50%),未见明显毒性(图2)。
总之,该研究成功开发了一种安全且高效的siRNA递送系统D/50C/50M,具有优异的肿瘤靶向性和生物安全性。较LNP制剂,体液中改变的蛋白冠组成使该类纳米粒肝脏蓄积量降低,肿瘤蓄积量显著增加。以上研究思路为肺癌的精准治疗提供了新的思路,有望推进siRNA药物的广泛临床应用。

郭华(左)、洪佳美(右)
北京大学药学院2020级直博生郭华及2021级直博生洪佳美为论文的共同第一作者, 杨振军教授为通讯作者。以上研究得到了中国科学技术部新药重大专项(2017ZX09303013)、北京市科学技术委员会、中关村科技园区管理委员会(Z231100004823026)、北京大兴生物医药产业基地(中国生物医药产业园)的支持。
论文链接:https://doi.org/10.1016/j.jconrel.2025.113624
杨振军教授简介:

杨振军,北京大学药学院教授、天然药物及仿生药物全国重点实验室PI。1987年获得北京医科大学药学专业学士学位,1998年在该校获药物化学专业理学博士学位, 2000-2002年在美国佐治亚大学药学院从事博士后研究, 2008年起任现职。曾任国家自然科学基金委员会化学学部化学生物学流动项目主任及北京大学药学院药物化学系副主任,现任中国化学会化学生物学和中国药学会药物化学、核酸药物专业委员会委员。主要研究方向:(1)核酸药物的化学修饰和新型靶向制剂研究;(2)基于核酸适配体的疾病检测新技术研究;(3)环核苷酸类信使分子化学生物学研究。发表研究论文160多篇,申请和授权专利30余项。负责科技部新药重大专项、973项目课题、重大863项目课题、国家自然科学基金委重点课题子课题和面上课题多项。曾获教育部自然科学一等奖1项、二等奖2项,国家自然科学二等奖1项。
天然药物及仿生药物全国重点实验室 供稿