
近日,我院天然药物及仿生药物全国重点实验室林文翰/范爱丽团队在国际专业期刊《美国化学会志》(Journal of the American Chemical Society)上发表了题为“Target Discovery of Dhilirane-Type Meroterpenoids by Biosynthesis Guidance and Tailoring Enzyme Catalysis”(利用Biosynthesis Guidance和Tailoring Enzyme Catalysis定向挖掘真菌DMOA来源的杂萜类分子)的最新研究成果。

DMOA来源的杂萜类分子在真菌中广泛存在,具有复杂多样的结构和广泛的生物学活性。几十年来,在基于DMOA来源的杂萜类分子生物合成的深入研究中发现,后修饰酶包括Fe(II)/α-KG依赖的加氧酶(α-KG/D)和P450氧化酶在其结构多样性方面发挥着至关重要的作用。在DMOA来源的杂萜类化合物中存在一类亚型结构dhilirane型杂萜(DMs),Dhilirane型杂萜分子(DMs)以其独特的6/6/6/5/5环系结构,成为真菌萜类化合物中一个罕见的类别。迄今为止,仅鉴定出11个同系物,其化学多样性在很大程度上仍未被探索。DMs最初从Penicillium purpurogenum中分离得到,对卷心菜害虫的摄食具有抑制作用。值得注意的是,该类结构B/C环的非立体选择性桥头碳原子使其形成不同的多环体系,极大的拓展了该类结构的多样性,目前关于dhilirane型杂萜结构的生合机制仍不清楚。
林文翰/范爱丽团队利用对生物合成的理解,开发了一种通过基因组挖掘、代谢产物分析和后修饰酶催化来发现DMs的工作流程(图1)。据此,团队通过 NMR、HRESIMS 和 X-ray 等波谱学方法鉴定了23种新的DMs,其中包括7种新骨架结构(图2)。研究发现,Fe(II)/α-酮戊二酸(α-KG)依赖型加氧酶DhiD能够催化dhilirolide D的非立体选择性环收缩,形成dhilirane骨架;而细胞色素P450酶DhiH则通过构建多种C-C键和氧化反应,重塑了DMs的结构多样性。晶体学和突变实验为DhiD的反应及其立体异构产物提供了分子基础(图3)。并且,DhiD在DMs化学扩展中表现出底物控制的催化多功能性,通过缩环、羟化、脱氢、环氧化、异构化、差向异构化和α-酮醇裂解等反应发挥作用。生物活性实验结果表明DMs具有抗炎和杀虫活性。该工作揭示了自然界中DM生物合成的有力工具以及Fe(II)/α-KG依赖加氧酶和P450酶的功能多样性,这些发现为DM型天然产物的靶点发现和多样化研究提供了新的思路和工具。
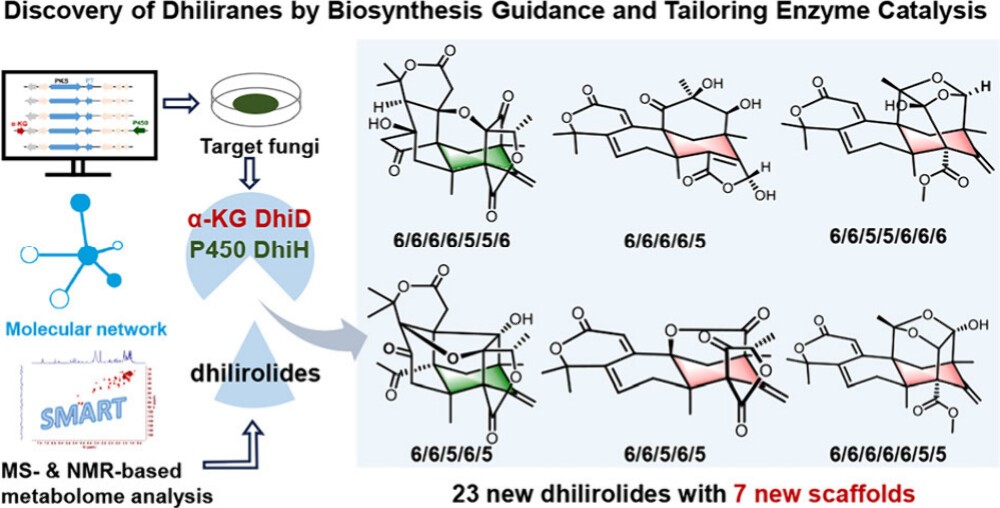
图1. 研究工作概述
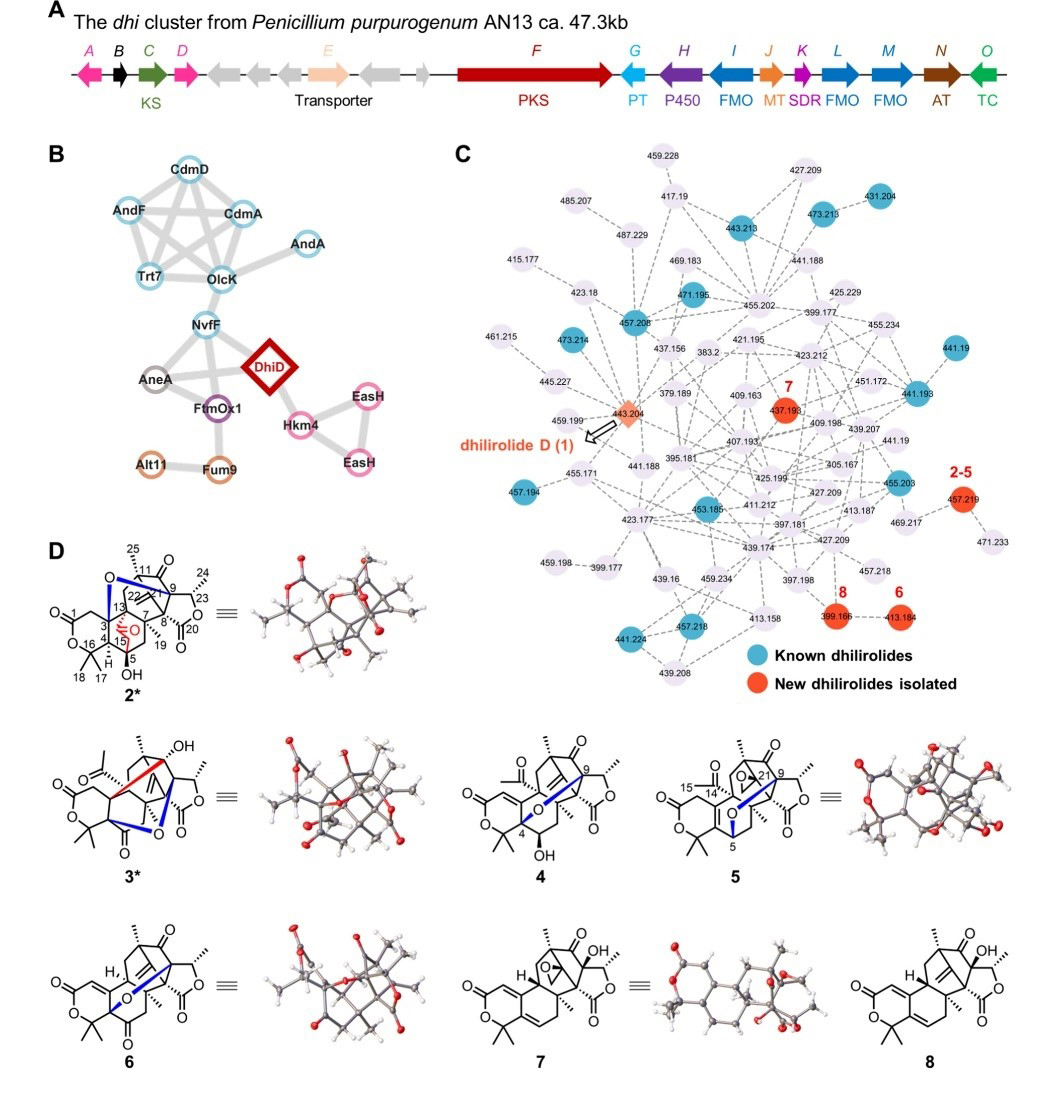
图2. 通过基因组挖掘和代谢组分析发现新的 DMs
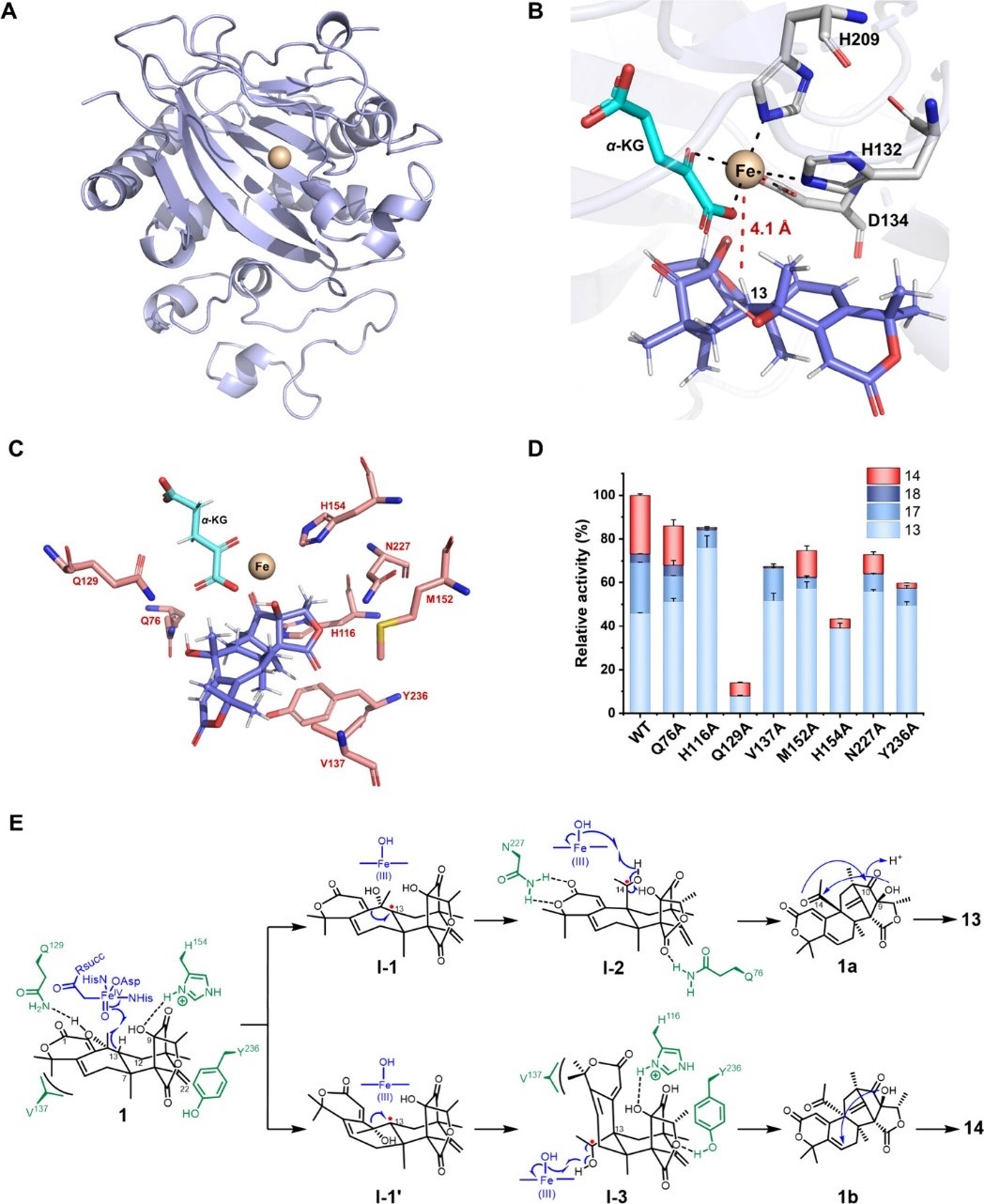
图3. DhiD的催化机制
北京大学药学院博士研究生孙照伦、吴梦月为共同第一作者,北京大学药学院林文翰教授,范爱丽副教授为该论文共同通讯作者。这项工作得到了国家重点研发计划、国家自然科学基金和宁波市重点科技发展计划的支持。
论文链接:https://doi.org/10.1021/jacs.4c09298
作者简介:

林文翰,北京大学药学院教授,博士生导师。北京大学天然药物及仿生药物全国重点实验室教授,现任北京大学宁波海洋药物研究院副院长,兼任中国药学会海洋药物专业委员会主任委员、国家科技部“十三五”深海生物专项咨询专家等。主要从事海洋生物天然产物结构与生物活性关系、海洋药物先导化合物发现等研究。

范爱丽,北京大学药学院副教授,硕士生导师。主要研究领域为海洋真菌活性次级代谢产物发现与生物合成、海洋真菌次级代谢产物合成途径中关键酶的鉴定及催化机制研究、利用合成生物学技术构建活性代谢产物的细胞工厂。
天然药物及仿生药物全国重点实验室 供稿