
核酸是一类能够贮存遗传信息的重要生物分子,其自身及所编码的功能蛋白参与许多生命过程。用以调控基因水平生理过程及疾病治疗的多种功能寡核苷酸是当前的研究热点,包括反义核酸(ASOs)、小干扰RNA(siRNA)、miRNA(microRNA)、核酶(ribozyme)、核酸适配体(aptamer)、mRNA、质粒(plasmid)以及环二核苷酸(cDNs)等。其生理条件下呈负电性,克服体内环境障碍并有效递送是亟需解决的问题。

我院天然药物及仿生药物国家重点实验室杨振军教授团队发展的中性胞苷脂材(DNCA)联合胱氨酸骨架阳离子脂材CLD纳米制剂,以氢键/π-π堆积作用及电性作用与核酸药物结合,已经实现了核酸适配体(Biomaterials, 2018)、反义核酸(Biomaterials, 2019)等的瘤旁注射给药,siRNA(Mol Ther Nucleic Acids, 2021)静脉注射给药及新冠mRNA疫苗的肌注给药(J Control Release, 2021), 治疗效果显著,肝肾毒性很低,未见免疫原性。
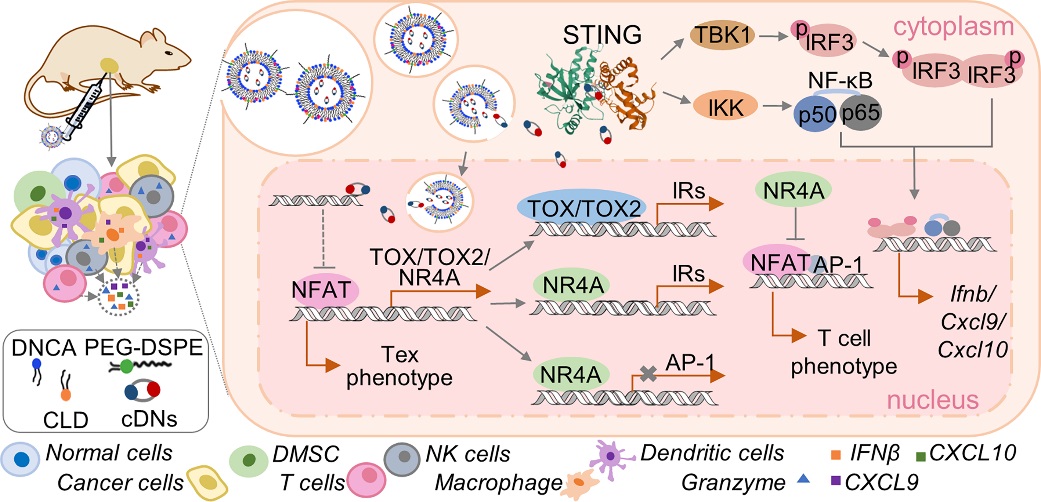
杨振军教授团队在环二鸟苷酸及其类似物的成药性研究中,基于混合脂材DNCA/ CLD(Mix)递送系统,实现了该类药物的高效细胞转染和体内递送,优化的cdG/Mix诱导IFN-Ⅰ能力是未包载cdG的50倍,可诱导黑色素瘤和乳腺癌细胞发生免疫原性死亡(0.5~1.4 μM)。cdG/Mix瘤内(0.1 μg/只)及静脉(2 μg/只)给药均可显著抑制乳腺癌及黑色素瘤小鼠的肿瘤生长,实现了荷瘤小鼠体内CD8+ T和NK细胞的全身性活化和募集,~43%的小鼠实现了长期生存,83%的长期存活小鼠再次接种肿瘤未见肿瘤生长,产生了肿瘤特异性免疫记忆。该研究首次报道了cdG/Mix肿瘤免疫治疗作用的新机制,即逆转荷瘤小鼠全身的T细胞耗竭(Tex)状态,CD8+ T细胞中的Tex发展关键因子Tox和Nr4a 的mRNA表达水平均显著下调。
该项成果"Novel formulation of c-di-GMP with cytidinyl/cationic lipid reverses T cell exhaustion and activates stronger anti-tumor immunity"于2022年9月在《Theranostics》杂志上发表。北京大学基础医学院/药学院博士后于小桐(2018级药学院博士生)和药学院博士生于晶(2016级药学院本硕生)为论文共同第一作者, 北京大学天然药物及仿生药物国家重点实验室杨振军教授为该文通讯作者。

于小桐、于晶
以上研究得到了中国科学技术部新药重大专项(2017ZX09303013)、国家自然科学基金委和河南省联合基金重点项目(No. 2017ZX09303013)和国家自然科学基金委面上项目(21572013)的支持。
原文链接:http://dx.doi.org/10.7150/thno.71010
【杨振军教授简介】

杨振军,北京大学医学部药学院教授、天然药物及仿生药物国家重点实验室PI。1987年获得北京医科大学药学专业学士学位,1998年在该校获药物化学专业理学博士学位, 2000-2002年在美国佐治亚大学药学院从事博士后研究, 2008年起任现职。曾任药物化学系副主任、国家自然科学基金委员会化学学部化学生物学流动项目主任,现任中国化学会化学生物学和中国药学会药物化学专业委员会委员。主要研究方向:(1)核酸药物的化学修饰和新型靶向制剂研究;(2)基于核酸适配体的疾病早期检测新技术研究;(3)环核苷酸类信使分子化学生物学研究;(4)核苷类抗病毒药物研究。发表研究论文160多篇,申请和授权专利26项。负责科技部新药重大专项、973项目课题、重大863项目课题、自然基金委重点课题子课题和面上课题多项。曾获教育部自然科学一等奖1项、二等奖2项,国家自然科学二等奖1项。
天然药物及仿生药物国家重点实验室 供稿