

2023年1月12日,我院天然药物及仿生药物国家重点实验室马明研究团队在ACS Catalysis上发表了题为“Structural Insight into a Metal-Dependent Mutase Revealing an Arginine Residue-Covalently Mediated Interconversion between Nucleotide-Based Pyranose and Furanose”的研究论文。该研究阐明了呋喃糖环生物合成中第一个离子依赖型变位酶(mutase)的晶体结构,并揭示了一种精氨酸共价结合底物介导的吡喃糖环和呋喃糖环的相互转化机制。
呋喃糖(五元环)通常比相应的吡喃糖(六元环)具有更差的热力学偏好性,但在自然界中呋喃糖却是细菌、真菌、植物中细胞壁和果胶等的重要结构单元,比如呋喃半乳糖是细菌细胞壁多糖的组成单元,而呋喃阿拉伯糖是植物果胶的组成单元。除了作为初级代谢产物的结构单元外,呋喃糖还是一些重要天然产物的合成原料,比如呋喃半乳糖和呋喃岩藻糖分别是抗生素A201A和hygromycin A的生物合成单元。
鉴于呋喃糖在自然界的广泛存在和重要作用,对于自然界如何形成呋喃糖的生物合成机制,无论在初级代谢还是次级代谢中都比较引人关注。目前的研究表明这些呋喃糖是通过它们对应的吡喃糖的缩环反应形成的,而催化此缩环反应的生物合成酶称为变位酶(mutase)。变位酶可以催化核苷连接吡喃糖和呋喃糖之间的相互转化,并已有两类变位酶被报道:一类是黄素依赖的变位酶(以黄素FAD或FMN为辅因子),另一类是离子依赖的变位酶(以二价离子如Mg2+和Mn2+为辅因子)。黄素依赖的变位酶已经有超过50个三维结构被PDB发布,且它们的催化机制也被阐明(黄素辅因子共价结合底物介导缩环反应),而目前尚没有离子依赖变位酶的结构和催化机制报道。
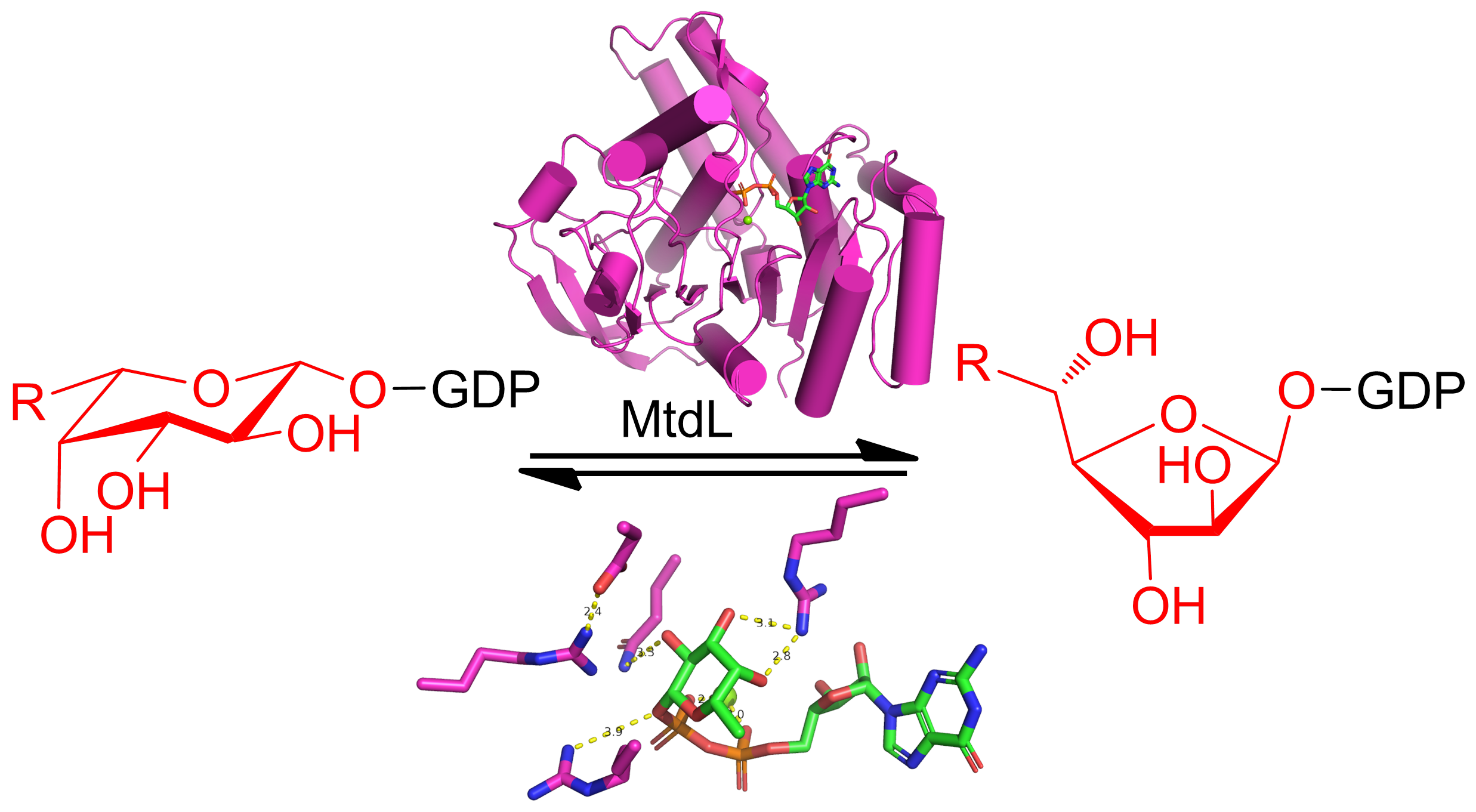
本研究团队针对天然产物A201A生物合成中的一个离子依赖变位酶(MtdL)的结构和催化机制开展了研究。解析了MtdL的母体和MtdL-GDP-Mg2+复合物晶体结构,发现该酶的结构与PDB中已发布的酶结构具有较大的差别。Dali三维结构比对分析中与MtdL最相似的为糖基转移酶GlfT2(分支杆菌细胞壁中呋喃半乳糖基转移酶)结构,然而相似度仍然较差,且两者相似的只是结构中的“罗斯曼折叠”(Rossmann-like fold)片段。毋庸置疑,MtdL与黄素依赖变位酶的三维结构完全不同,提示其具有不同的催化机制。
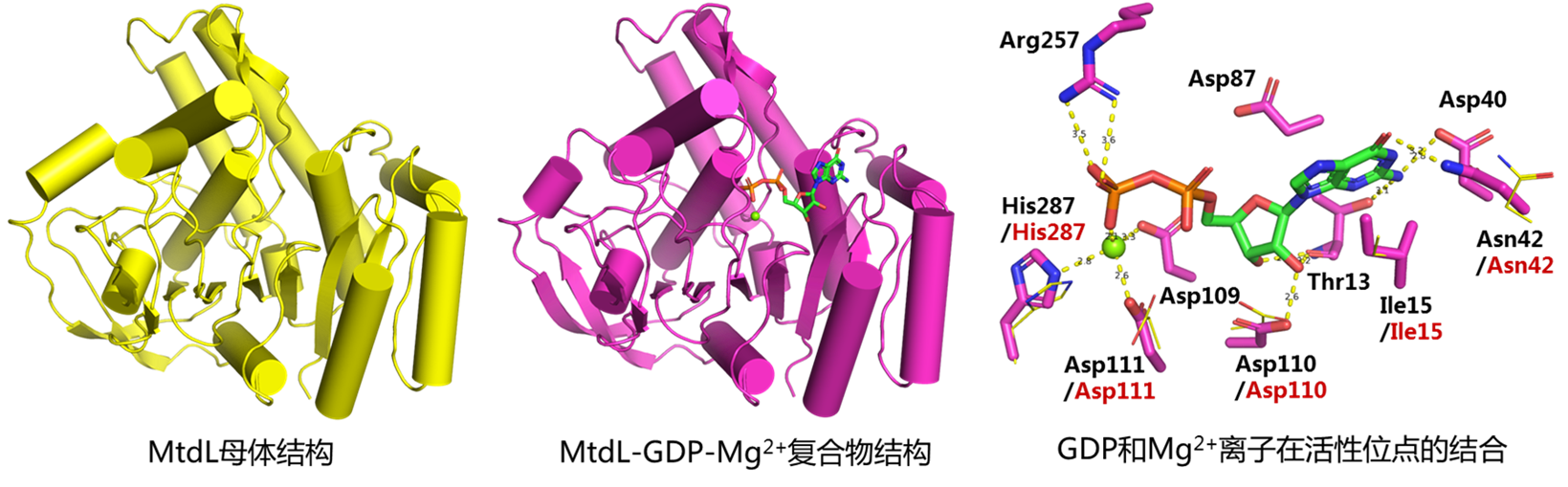
基于MtdL-GDP-Mg2+复合物晶体结构,研究团队通过分子动力学模拟对催化机制开展了研究。对底物、中间体和产物的分子动力学模拟揭示了活性位点的重要氨基酸残基,推测其中一个精氨酸Arg159可能通过共价结合底物来介导吡喃糖向呋喃糖的转化。对Arg159和其它残基的定点突变实验验证了它们的重要功能。为了确证Arg159共价结合底物的催化模式,将MtdL与底物孵育后用胰蛋白酶水解,再用质谱蛋白组学方法进行了分析。结果表明一个含有Arg159的肽段给出了一系列碎片离子,均清晰地指向底物共价结合在Arg159上,从而佐证了MtdL的催化机制。将MtdL与其它离子依赖变位酶(比如初级代谢中负责植物果胶中呋喃阿拉伯糖生物合成的UAMs)进行序列比对,发现Arg159联同其它活性残基均保守存在,提示这些离子依赖变位酶可能具有跟MtdL类似的催化机制。
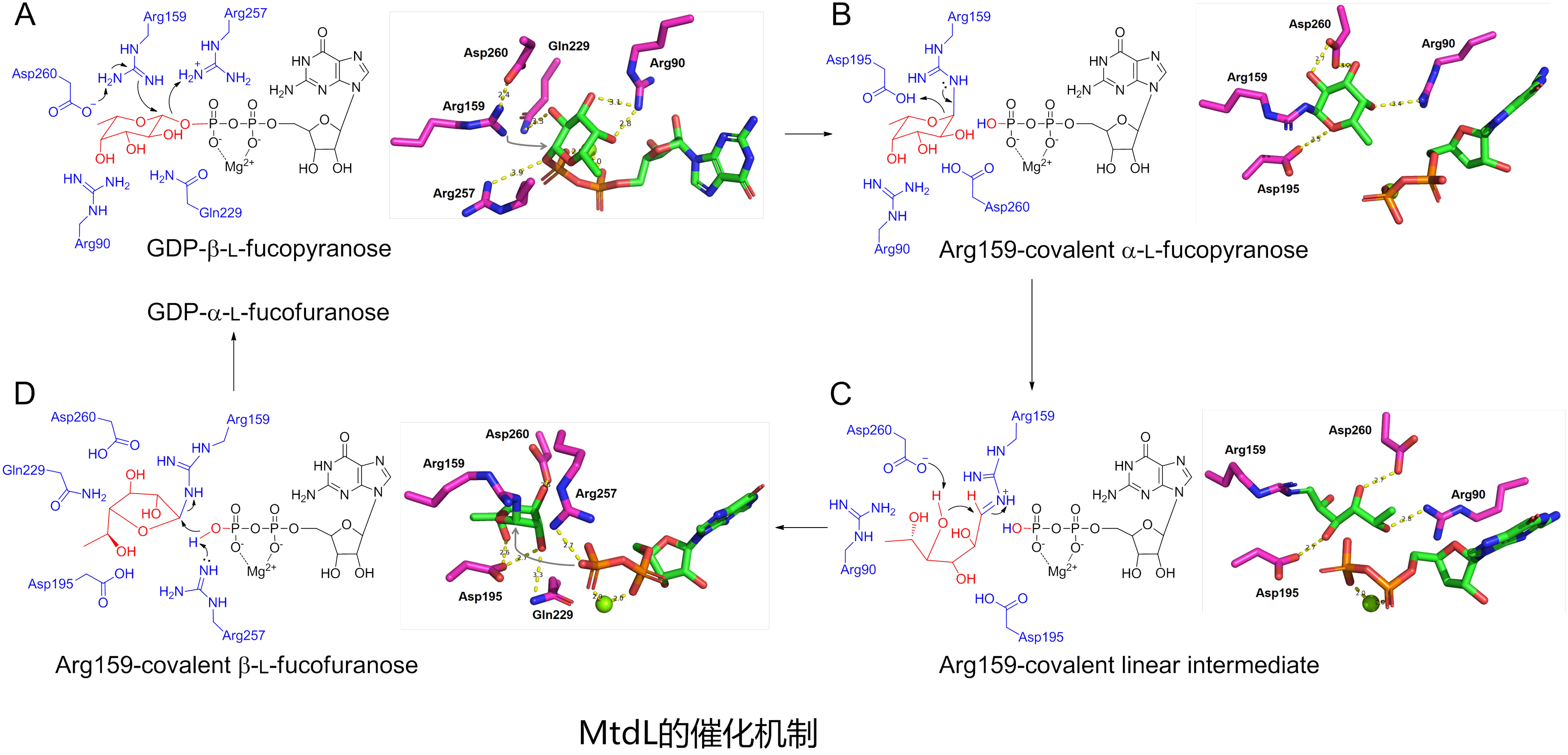
综上所述,该研究首次阐明了呋喃糖生物合成中离子依赖变位酶的结构和催化机制,为该类酶的工程改造及呋喃糖的酶学制备提供了依据。该研究的另外一个亮点是:运用精氨酸作为关键残基催化反应的酶屡见不鲜,但是它们通常利用精氨酸形成氢键和盐桥的能力进行催化;运用精氨酸通过共价结合底物的方式进行催化的酶非常罕见。因此该研究对MtdL催化机制的揭示也增加了对精氨酸在生化反应中角色的认识。
该项工作得到科技部重点研发计划和国家自然科学基金委等资助。北京大学药学院博士后池昌标(现供职于华侨大学生物工程与技术系)为本论文第一作者,北京大学药学院马明研究员、中国科学院南海海洋研究所李青连研究员为共同通讯作者。该研究为中国科学院南海海洋研究所鞠建华团队前期工作(PNAS, 2017, 114, 4948-4953; Organic Letters, 2018, 20, 1015-1018.)的延续,感谢鞠建华研究员的大力支持!
原文链接:https://doi.org/10.1021/acscatal.2c04907
第一作者:

池昌标 博士后
通讯作者简介:

马明,北京大学药学院、天然药物及仿生药物国家重点实验室研究员,博士生导师,长聘副教授。研究领域为天然药用分子的生物合成、酶的三维结构及其催化机制、天然产物合成生物学。近5年以通讯作者在Angew. Chem. Int. Ed.、JACS、ACS Catal.、Chem. Sci.、Acta Pharm. Sin. B.、Commun. Chem.、Org. Lett.、ACS Chem. Biol.、J. Biol. Chem.、J. Org. Chem.、J. Nat. Prod.等国际学术期刊发表论文18篇。任中国药学会海洋药物专业委员会委员、中华中医药学会青年委员会委员、北京药学会天然药物专业委员会委员。
天然药物及仿生药物国家重点实验室 供稿