
2024年10月24日,我院天然药物及仿生药物全国重点实验室张亮仁团队和黄卓团队合作在国际著名期刊Journal of Medicinal Chemistry 在线刊登了最新研究成果“Discovery of Potent and Selective Blockers Targeting the Epilepsy-Associated KNa1.1 Channel”。

KNa1.1 通道是由基因KCNT1编码,并受胞内Na+调控的钾离子通道。KCNT1的错义突变多表现为功能增强型突变,会诱发早发、难治、耐药性癫痫表型, 包括EIMFS、(AD)SHE、早发性癫痫性脑病等。尽管目前临床上已经有传统抗癫痫药物、奎尼丁和生酮饮食疗法等多种治疗方法,其中奎尼丁作为钾通道阻断剂,在治疗上表现出一定的前景,但是存在BBB渗透性差、副作用大、疗效不稳定的问题。目前KCNT1相关癫痫的临床治疗仍面临着巨大挑战。张亮仁/刘振明团队利用虚拟筛选结合实体化合物库进行组合筛选,并通过结构优化和活性评价,以期发现新型KNa1.1通道抑制剂,推动KCNT1相关癫痫治疗药物的发现。
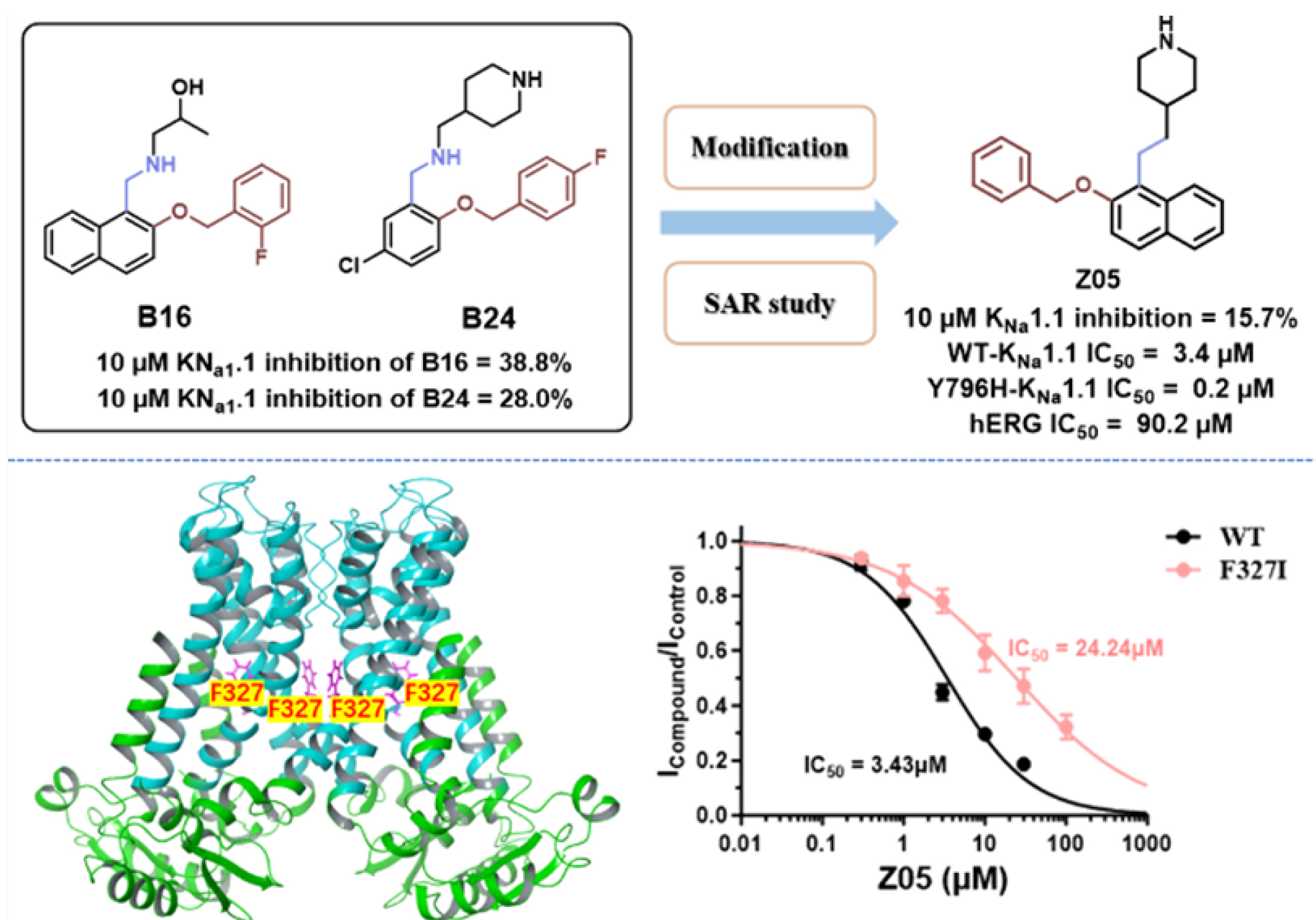
该研究首先通过同源建模构建了KCNT1通道孔模型,并应用于虚拟筛选。并对虚筛命中的化合物通过基于TF3P的三维相似性搜索展开对PKU-DDC化合物库的第二轮筛选。最终命中苗头化合物D30(IC50 = 4.25 μM),并基于该化合物开展进一步的结构优化,得到了一系列取代芳甲胺类的新型KNa1.1抑制剂。其中,六个化合物(5.78 μM ≤ IC50 ≤ 1.91 μM)表现出对KNa1.1通道的抑制活性显著强于阳性药奎尼丁(IC50 = 98.39 μM)和苄普地尔(IC50 = 16.27 μM),并被选择进行离子通道选择性研究,测试对癫痫或心脏毒性相关通道Nav1.2、Nav1.5、hERG和BK通道的抑制活性。化合物Z05(WT-KNa1.1: IC50 = 3.43 μM; Y796H-KNa1.1: IC50 = 0.23 μM; hERG: IC50 = 90.23 μM)相对于其他化合物表现出更好的离子通道选择性。位点突变研究进一步确定了化合物Z05的结合位点和对耐药突变体Y796H-KNa1.1的抑制作用,并且Z05具有较好的药代动力学性质。化合物Z05的发现为进一步的KCNT1相关癫痫药物开发提供了有价值的体外工具化合物。
该论文主要针对目前关于KCNT1相关癫痫临床治疗难以管理的问题,发现新型KNa1.1通道抑制剂,推动KCNT1相关癫痫治疗药物发现。
北京大学药学院2023级博士生郑汝秋、北京大学药学院2016级长学制学生王秋风(现)和北京大学药学院李忠堂助理研究员为该论文的共同第一作者,药学院张亮仁教授、黄卓教授、刘振明研究院,李忠堂助理研究员为该论文的共同通讯作者。
论文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c01815
团队负责人简介:

张亮仁,北京大学药学院教授、博士生导师。曾任北京大学药学院药化系主任,中国药学会药物化学专业委员会委员,Heterocycles、Drug Discov. Ther.、Molecules、《药学学报》、《中国药物化学杂志》、《中国药学(英文版)》、《中国药学杂志》等期刊的编委或顾问编委。主要以结构为基础的药物设计与合成。先后主持包括国家自然科学基金、教育部博士点基金、新药创制重大专项等在内的多项科研项目。在国内外学术杂志发表研究论文170 余篇,曾获2002 年教育部自然科学奖二等奖(第2 完成人)、 2004 年国家自然科学二等奖(第2 完成人)。

黄卓,北京大学药学院教授、博士生导师,现任副院长。担任北京大学天然药物及仿生药物全国重点实验室和北京大学麦戈文脑研究院的研究负责人(PI),入选“万人计划”青年拔尖人才和教育部新世纪人才计划。专注于脑重大疾病的药物靶标发现和药物研发工作,以通讯作者或第一作者在Nature Neuroscience, Nature Comminications,Science Advances,Biological Psychiatry,Cell Discovery等发表SCI论文50多篇。兼任4本SCI期刊编委,参编出版学术专著6部。现为中国药理学会、北京药理学会和北京药学会理事。
天然药物及仿生药物全国重点实验室