
靶向蛋白质降解(TPD)技术是近年来药物研发领域的前沿方向,通过利用细胞内的泛素-蛋白酶体系统来降解“不可成药”的蛋白质,为癌症等疾病的治疗提供了新的思路。然而,传统的TPD技术在开发过程中面临着靶向弹头和连接子优化的挑战。

为了突破这些瓶颈,2025年2月5日,北京大学药学院天然药物及仿生药物全国重点实验室张力勤研究员团队在Chem杂志上发表了题为“Systematic evolution of functional oligonucleotides for targeted protein degradation”的研究论文,提出了一种基于核酸适体的系统性进化平台,用于高效开发靶向蛋白质降解分子。研究团队开发了一种微珠展示的寡核苷酸-E3连接体嵌合文库,并利用体外泛素化系统结合荧光检测及微珠筛选,以鉴定高亲和力的适体-嵌合降解剂,这些分子能够结合靶蛋白并招募E3连接酶进行泛素化修饰。该方法在CRBN和VHL两种E3连接酶的测试中成功降解了BRD4和IRAK4蛋白。此外,团队还建立了系统进化双特异性RNA适体的方法,开发出了一种双特异性RNA适体降解剂,展示了该平台的广泛适用性。这一技术不仅为癌症治疗提供了新的工具,还为蛋白质功能的调控开辟了新的途径。
研究内容
DNA-pomalidomide嵌合体用于靶向蛋白降解
研究团队首先开发了一种基于DNA适体的BRD4降解平台,通过CRBN配体泊马度胺(pomalidomide)修饰DNA文库,并结合点击化学和微珠筛选,筛选出高效的BRD4降解剂。筛选出的适体嵌合体PA2结合亲和力为5.3 nM,在500 nM浓度下可使BRD4降解率达87%。细胞实验显示PA2具有浓度和时间依赖性的降解作用。这些结果表明PA2具有作为BRD4降解剂的潜力。
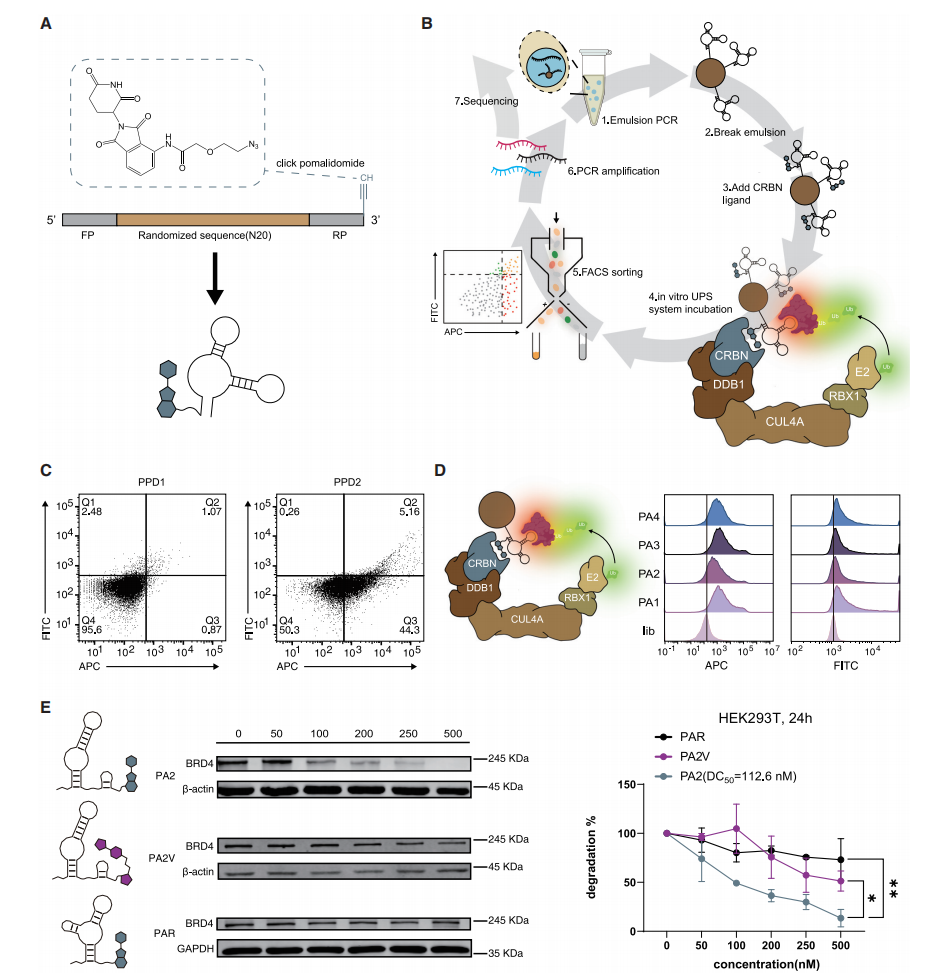
图一:诱导BRD4蛋白泛素化及蛋白酶体水解的适体-泊马度胺嵌合体的进化
吲哚修饰的DNA-VH032嵌合体用于靶向蛋白降解
随后,研究团队优化了E3连接酶VH032在适体中的位置,使其更接近随机区,以提升三元复合物的形成效率,并在文库中引入吲哚基团以提高适体亲和力。通过乳液PCR和点击化学构建微珠文库,并进行两轮功能筛选,最终筛选出降解效率最高的适体VIA2(VHL和吲哚修饰的适体2),其KD值为2.0 nM,在500 nM浓度下BRD4降解率达79.4%,优于PA2。此外,该方法成功筛选出针对IRAK4的适体降解剂SHA1,表现出浓度和时间依赖性的降解效果,进一步证明了该平台的广泛适用性。
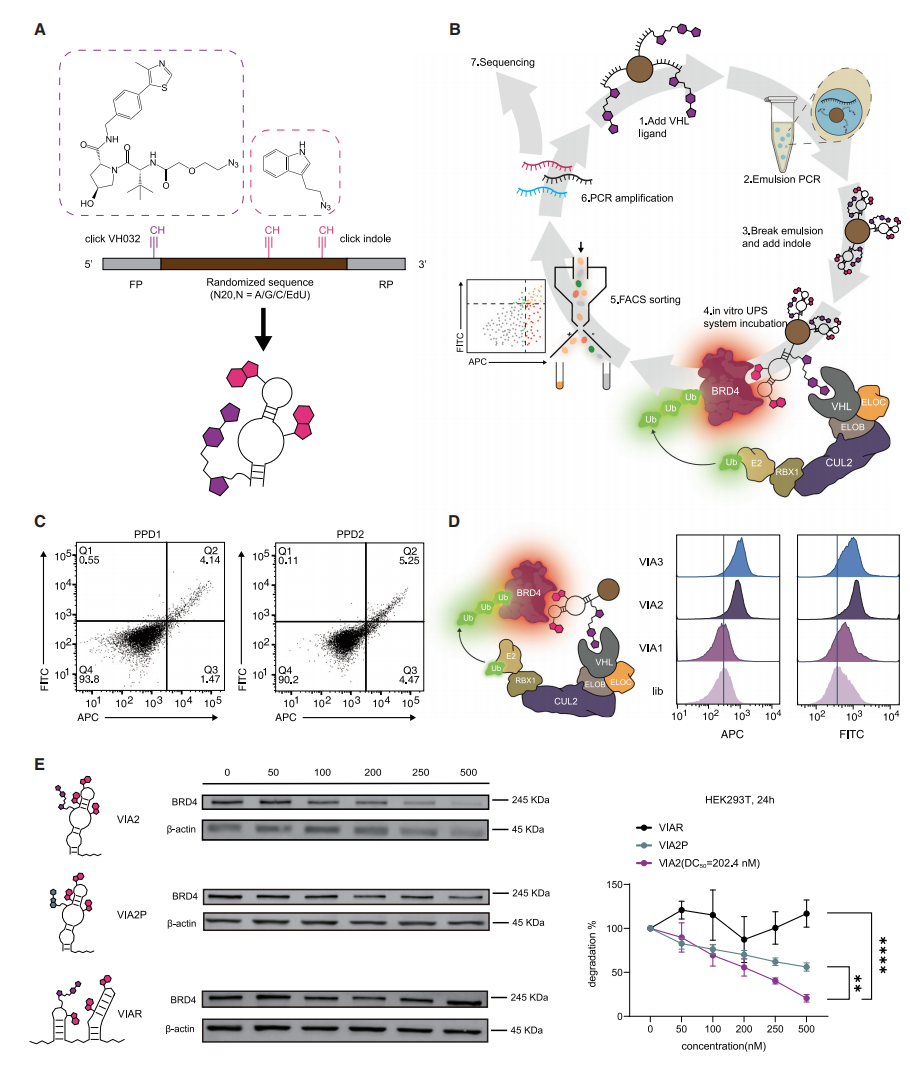
图二:诱导BRD4蛋白泛素化及蛋白酶体水解的适体-VH032嵌合体的进化
双特异性RNA靶向降解剂的开发
研究团队进一步设立了更具挑战性的目标,即建立系统进化双特异性RNA适体的方法,用于靶向蛋白降解(TPD)。他们开发了一种基于乳液NASBA(eNASBA)的RNA微珠文库构建方法,并结合功能筛选,以优化降解效率。针对BRD4和VHLE3连接酶,通过筛选获得了唯一具有体外泛素化能力的双特异性适体BRA1,其KD值为0.9nM,在500nM浓度下降解率达79.2%。这一方法为双特异性RNA适体在TPD领域的应用奠定了基础。
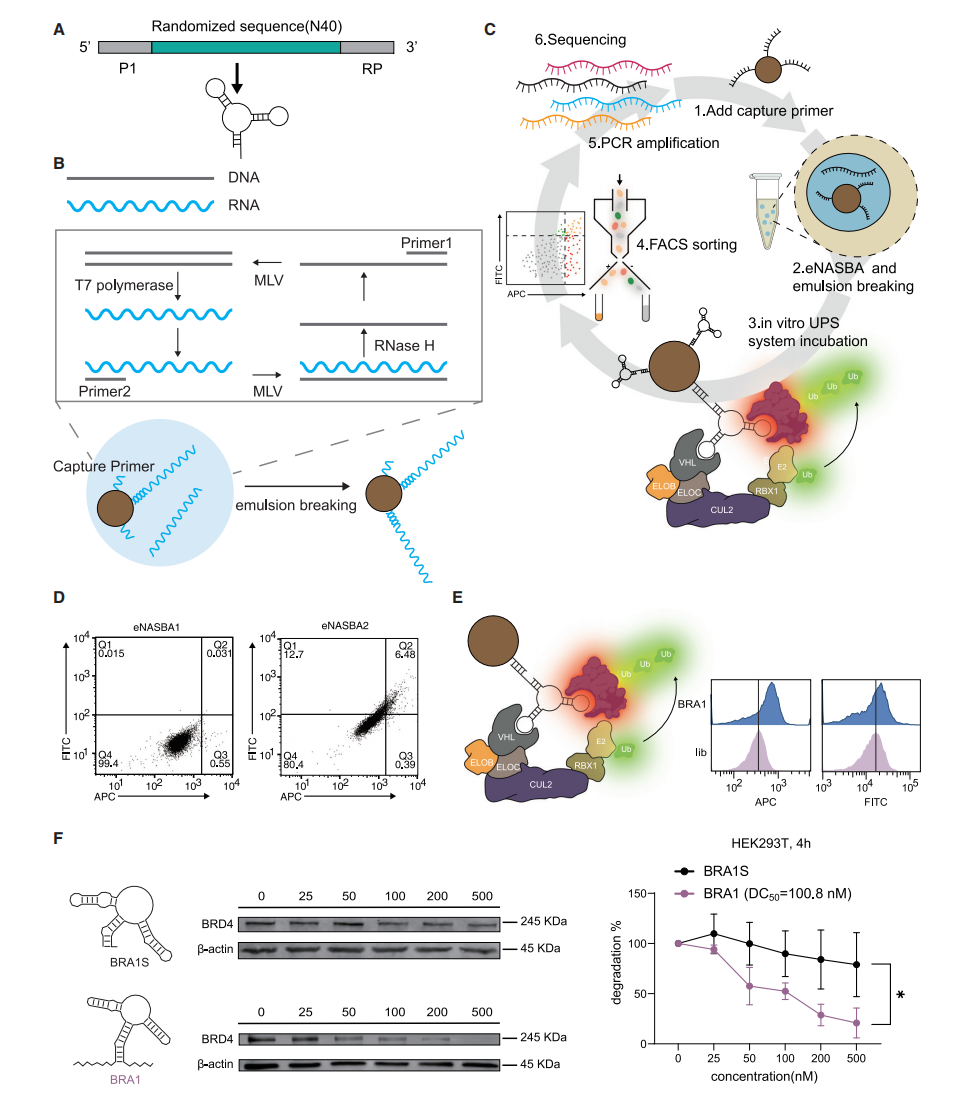
图三:诱导BRD4蛋白泛素化及蛋白酶体水解的双特异性RNA适体的进化
三种降解剂的体内效果评估
研究团队评估了两种适体嵌合体(PA2和VIA2)对肿瘤抑制的效果。在BRD4蛋白高表达的肝癌细胞Hep3B中,PA2和VIA2以浓度和时间依赖性诱导BRD4的降解,并显著降低细胞存活率,增加细胞凋亡率。在皮下肿瘤模型中,采用递送载体进行瘤内注射后,适体嵌合体组的肿瘤生长显著减缓,并且BRD4及增殖标志物Ki67在肿瘤组织中均显著下降,表明PA2和VIA2通过降解内源性BRD4发挥抗肿瘤作用。
此外,在高表达BRD4蛋白的黑色素瘤细胞A375中,双特异性RNA降解剂BRA1展现出比DNA嵌合体更快的BRD4降解能力,并导致细胞存活率降低和凋亡率上升。在A375皮下肿瘤模型中,瘤内注射BRA1也显著抑制了肿瘤生长,并在肿瘤组织中验证了BRD4的降解。这些结果表明,适体嵌合体和RNA降解剂均能有效靶向BRD4,发挥强效的抗肿瘤作用。
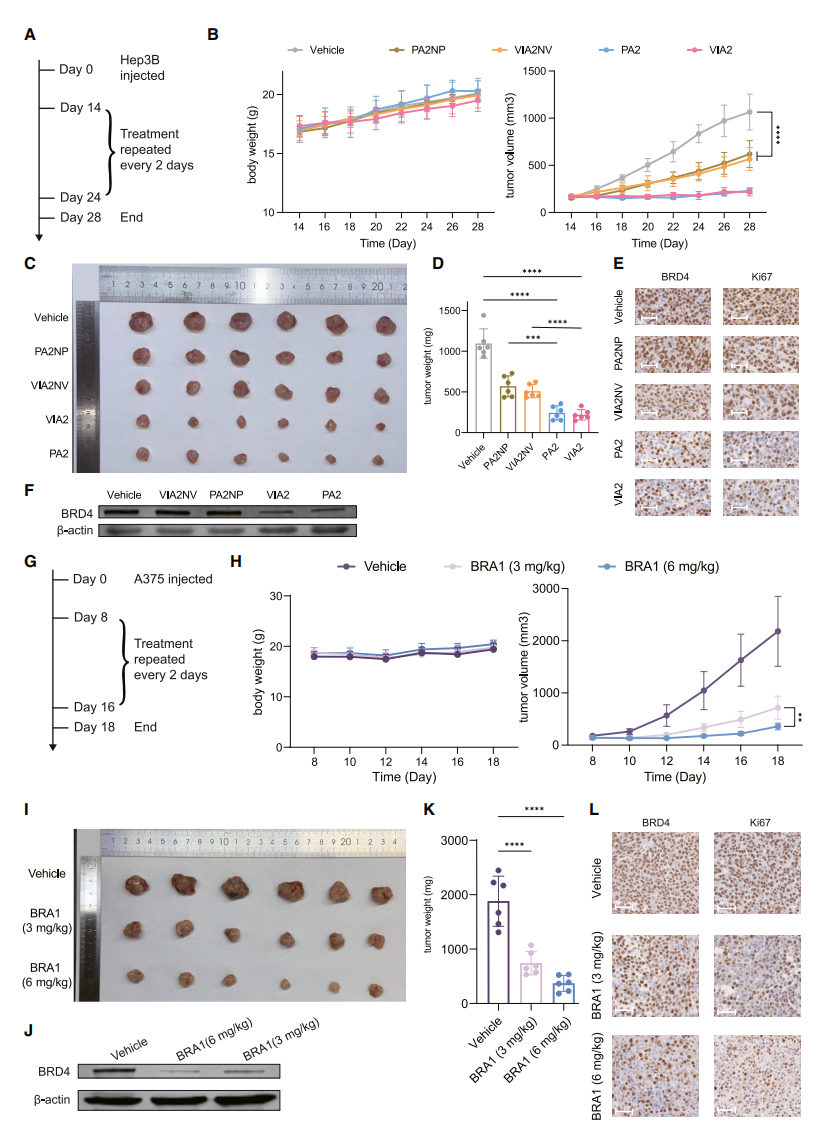
图四:BRD4蛋白降解剂的细胞及动物评价
总 结
本研究提出了一种基于适体的蛋白降解(TPD)策略,利用适体嵌合体或双特异性适体同时结合靶蛋白(POI)和E3泛素连接酶,从而促进靶蛋白的泛素化并通过泛素-蛋白酶体系统降解。本研究开发了一个系统性进化平台,可针对几乎任何POI生成降解剂,实现精准的细胞内蛋白降解,并验证了该方法在多个靶蛋白上的适用性。研究发现,纯RNA适体比DNA及修饰DNA在降解效率上更优,同时RNA在多种递送策略中的兼容性使其成为细胞内治疗的优选模式。然而,适体降解剂的递送、稳定性和生物利用度仍是关键挑战,需要创新的修饰和递送系统来优化。此外,该策略不仅有助于药物开发,还可作为研究工具,用于蛋白降解、翻译后修饰调控等。整体而言,本研究扩展了适体在治疗和基础研究中的应用潜力。
北京大学药学院张力勤研究员为论文的通讯作者。北京大学药学院22级直博生苏凰、19级六年制陈怡帆、17级六年制赵旭洋该研究的共同第一作者。团队成员路曾忆、魏同萱、刘钦国、刘西洋、张钦淏、卞思琪、邱千伟、姚盼竹,以及苏州予路乾行生物科技有限公司刘文朗和郑铮博士,北京大学肿瘤医院的徐达医生也为该研究做出了重要贡献。该项目获得了天然药物及仿生药物全国重点实验室测试平台、北京大学医药卫生分析中心和北京大学医学部实验动物科学部的大力支持。该研究获得国家重点研发计划、国家自然科学基金、北京大学医学+X基金等项目的支持。
论文链接:https://doi.org/10.1016/j.chempr.2024.102408
第一作者简介

苏凰,北京大学药学院药物分析学专业22级直博生,2022年获得湖南大学化学学士学位,研究方向为新型核酸适体药物筛选方法。

陈怡帆,北京大学药学院19级六年制药学专业硕士研究生,2023年获得北京大学药学学士学位,研究方向为RNA分子工具体外进化。

赵旭洋,西湖大学博士研究生在读。北京大学药学院17级六年制药学专业硕士研究生,2021年获得北京大学药学学士学位,2023年获得获得北京大学药物分析学硕士学位。
通讯作者简介

张力勤,博士,北京大学药学院助理教授、博士生导师,药物分析学系副主任、药学院科研办副主任,天然药物及仿生药物全国重点实验室研究员、课题组长。2009年毕业于北大药学院本硕六年制药学专业,2016年获得佛罗里达大学化学博士学位,曾在斯坦福大学医学院从事博士后研究工作,并在美国赛默飞世尔科技公司基因科学部担任高级科学家,2021年回国工作。主持基金委优秀青年基金、面上项目,“生物大分子与微生物组”重点研发计划课题、参与基金委重大科研仪器研制项目、“BT-IT”重点研发计划课题。担任Science China Chemistry杂志和Journal of Pharmaceutical Analysis杂志青年编委。研究方向聚焦于多元功能核酸分子工具的构建开发及其在药物筛选、生命分析和疾病诊疗中的应用。
天然药物及仿生药物全国重点实验室