
2025年3月24日,我院天然药物及仿生药物全国重点实验室吕万良教授团队在著名学术期刊Nature Communications在线发表了题为“A protease-cleavable liposome for co-delivery of anti-PD-L1 and doxorubicin for colon cancer therapy in mice“的研究工作。

肿瘤免疫检查点阻断治疗是一种变革性治疗新策略。其中,细胞程序性死亡受体1(PD-1)和细胞程序性死亡配体1(PD-L1)免疫检查点阻断治疗(PD-1/PD-L1),在晚期癌症的临床治疗中取得了显著进展,部分患者获得了长期缓解且无临床复发。然而,只有小部分结肠癌患者对该策略有治疗响应。为此,该研究研发了一种蛋白酶可裂解PD-L1抗体脂质体(eLipo anti-PD-L1),用于增强结肠癌免疫检查点阻断治疗。在结肠癌环境中,该脂质体可被内源性天冬酰胺内肽酶裂解为两部分:聚乙二醇化PD-L1抗体部分和靶向性脂质体部分(可共递送阿霉素),同时发挥免疫检查点阻断治疗和靶向化疗作用。功能评估显示,该脂质体具有结肠癌靶向性、天冬酰胺内肽酶响应性、癌组织深部穿透性、免疫激活和免疫杀伤效应,在原位结肠癌荷瘤动物体内表现出显著的治疗效应。
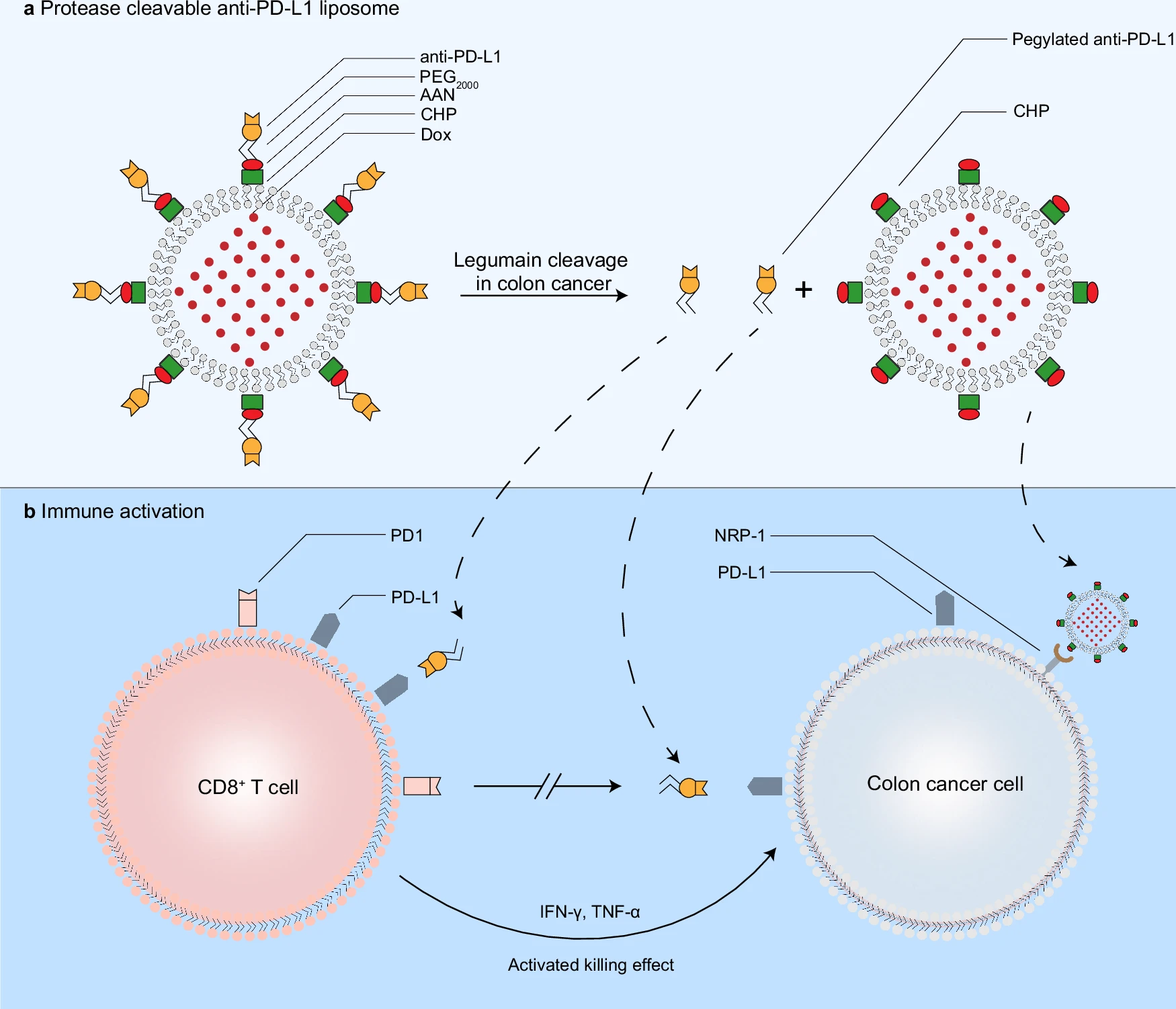
研究揭示,T细胞分化和T细胞受体信号通路相关基因参与了免疫激活效应;在结肠癌小鼠模型以及人结直肠癌组织样本中,PD-L1和天冬酰胺内肽酶均具有过度表达,提示蛋白酶可裂解PD-L1抗体脂质体具有良好应用前景。该研究对于发展肿瘤免疫治疗新的脂质体制剂策略奠定了理论和实验依据,具有重要的科学意义和潜在临床转化价值。
该研究得到国家自然科学基金支持。北京大学药学院2019级直博生刘懿萱、北京大学药学院谢英副教授为该论文的共同第一作者,吕万良教授为该文通讯作者。

刘懿萱 博士生(左)、谢英 副教授(右)

吕万良教授团队2023年合影
论文链接:https://www.nature.com/articles/s41467-025-57965-6
通讯作者简介:

吕万良,北京大学药学院长聘教授、博士生导师,分子药剂学与新释药系统北京市重点实验室常务副主任,天然药物及仿生药物全国重点实验室PI,中国药学会药剂专业委员会主任委员,中国颗粒学会常务理事;历任北京大学药学院党委副书记、国际控释学会中国分会主席等职务。在肿瘤/肿瘤干细胞耐药性、新型脂质体、基因重组制剂等生物药剂学领域取得重要进展。发表论文190余篇,主编北京大学长学制教材《现代药剂学》和《先进药剂学》、主编Springer Nature专著《Liposomes-Based Drug Delivery Systems》,入选Elsevier高被引中国学者,获2009 年、2012年教育部自然科学一等奖、2018年北京市科技二等奖、2019年教育部自然科二等奖等奖项。
天然药物及仿生药物全国重点实验室 供稿