
2022年7月29日,我院天然药物及仿生药物国家重点实验室徐正仁研究团队在国际著名期刊Angew. Chem. Int. Ed.(《德国应用化学》)上发表了题为“Biomimetic Total Synthesis of the Spiroindimicin Family of Natural Products”的研究论文,实现了Spiroindimicin家族系列天然产物的化学-酶法仿生合成。

Spiroindimicins是一类拥有 [5,5] 或 [5,6] 新颖螺环骨架的二聚色氨酸天然产物,具有显著的抗寄生虫等活性,从而成为全合成的目标分子。而目前仅有两个课题组实现了这类天然产物的全合成。根据生源途径,二聚色氨酸类天然产物都是以色氨酸为起始原料,经氧化二聚得到共同的中间体CPA,但催化其进一步发生C3ꞌ−C2"和C3ꞌ−C4"氧化偶联的酶至今尚未明确。在此研究背景下,北京大学徐正仁研究团队采取生物催化和化学氧化相结合的仿生合成策略,利用酶促反应获得关键中间体后,再通过区域选择性氧化偶联构建 [5,5] 和 [5,6] 螺环骨架,最终在6步以内实现了 (±)-spiroindimicins A,D,G和H的全合成。
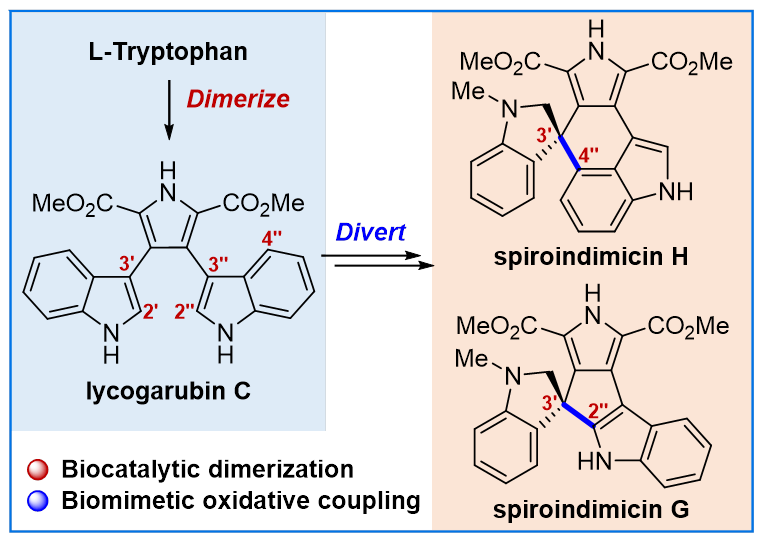
在生物催化部分,研究团队采用一锅双酶催化色氨酸(12a/12b)氧化二聚的方法制备关键的中间体化合物10a/10b。首先,研究团队比较了6种StaD同源蛋白对13a/13b的二聚反应效率,结合蛋白的表达量,最终确定VioB为该反应的合适酶。随后,以色氨酸12a/12b为起始原料,对8种StaO同工酶与VioB组合制备10a/10b的反应效率进行了考察。结果表明, LaStaO/VioB和LzrO/VioB的组合分别对12a和12b的反应效率最佳,而且可以直接采用粗酶进行反应,产物通过TMSCHN2进行甲酯化,可以分别以69%和37%的产率获得11a和11b。
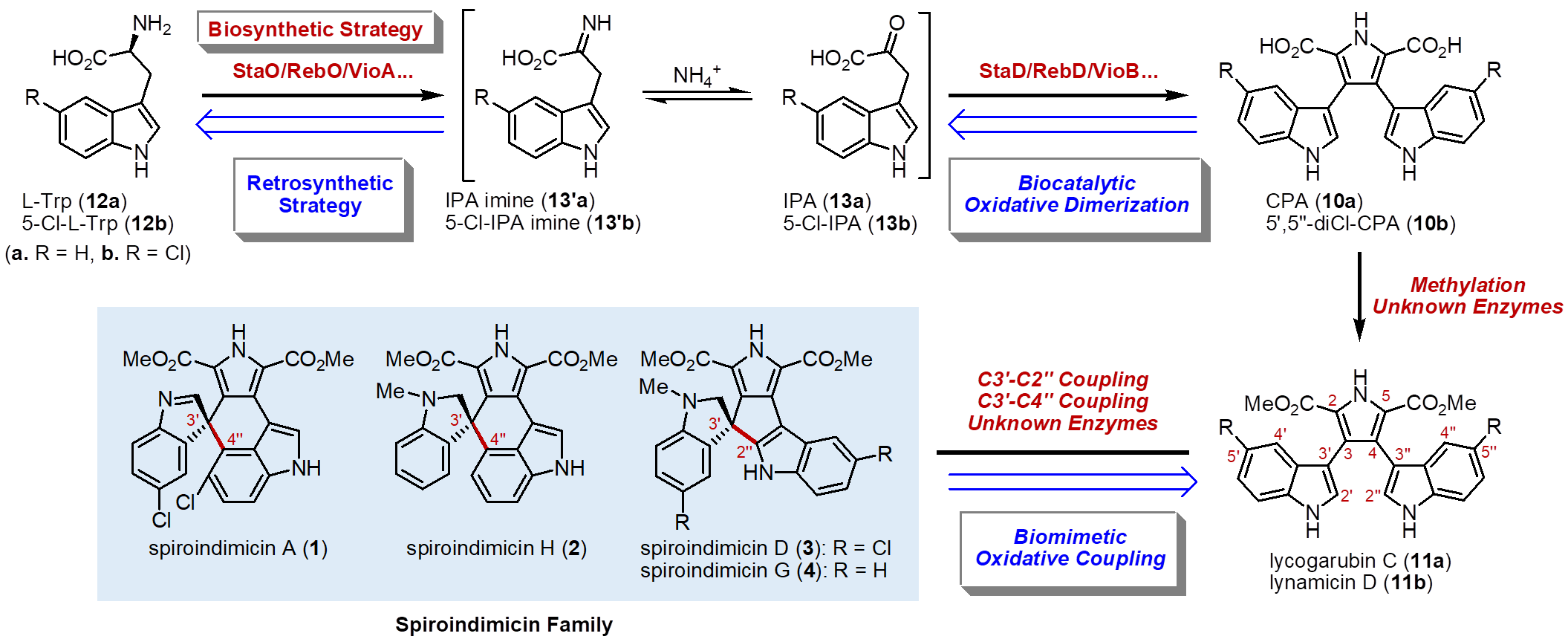
在化学氧化部分,研究团队首先对未保护前体11a 开展了C3ꞌ−C2"氧化偶联条件的筛选。虽然最初得到的都是C2ꞌ−C2"连接的吲哚咔唑产物,但在NCS的作用下作者终于得到了 [5,5] 螺环骨架的氧化产物。然而令人困惑的是,该产物只能通过制备TLC进行纯化。随后,作者对11a吲哚氮原子进行TBS保护后得到化合物14a,该化合物在TCCA/Al2O3的作用下可以35% (51% brsm) 的收率获得 [5,5] 螺环骨架化合物15a。最后,经过还原胺化和脱保护操作,即可完成 (±)-spiroindimicin G (4)的合成。而从14b出发,以类似的操作也可成功完成 (±)-spiroindimicin D (3)的合成。
接下来,作者继续以14a为底物对C3ꞌ−C4"氧化偶联的条件进行筛选。结果表明,14a在AgBF4/NIS/NaOH的作用下,可以77%的收率获得目标产物16a;进一步优化条件后发现在AgSbF6/NIS/NaOH的作用下,可以以接近定量的产率获得产物。在同样的条件下,14b也可以95%的产率转化成 [5,6] 螺环产物16b。作者还发展了以一锅的形式进行氧化偶联和还原胺化两步操作,可以顺利从16a出发对于完成(±)-spiroindimicin H (2)的合成。从16b出发,经过保护基脱除后,即完成 (±)-spiroindimicin A (1)的合成。
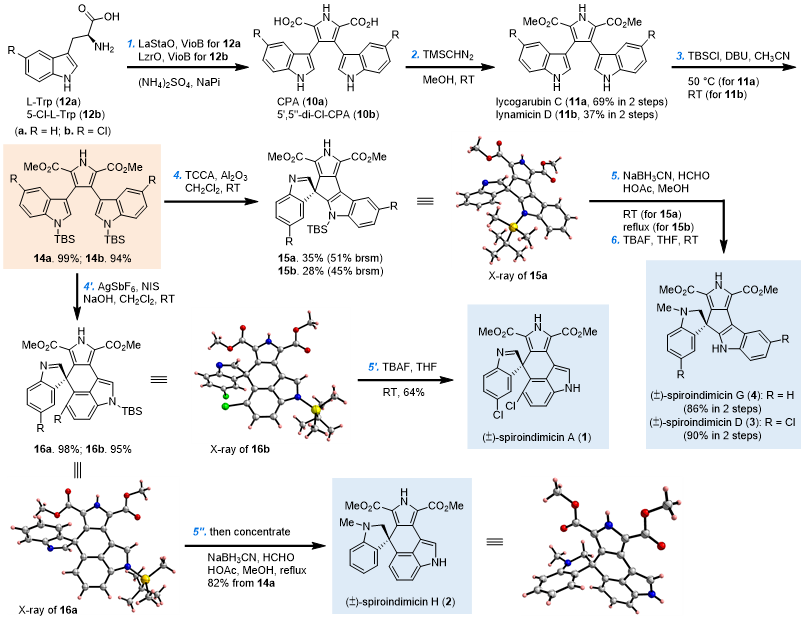
该研究过程合理地利用双酶催化体系一锅制备关键中间体10a/10b,而随后的区域选择性氧化偶联反应中保护基的引入和氧化剂的选择,则是该团队能够在6步以内合成spiroindimicins A,D,G和H的关键。
文章链接:https://doi.org/10.1002/anie.202208802

北京大学药学院博士后郑锡康、博士生李岩为本论文共同第一作者,北京大学药学院徐正仁研究员为本论文通讯作者。该项目工作得到了国家自然科学基金、科技部国家重点研发计划、北京市自然科学基金等的资助。
【通讯作者简介】

徐正仁,北京大学药学院、天然药物及仿生药物国家重点实验室研究员,博士生导师。研究领域为新型酶催化反应研究、生物催化及其在天然产物合成中的应用。近年来在JACS、PNAS、Angew. Chem. Int. Ed.等国际学术期刊发表多篇研究论文。
天然药物及仿生药物国家重点实验室 供稿