
2025年5月7日,北京大学药学院叶敏教授团队与华东理工大学蔡孟浩教授团队在JACS杂志上发表题为《Molecular and Structural Characterization of a Chalcone di‑C‑Methyltransferase RdCMT from Rhododendron dauricum and Its Application in De Novo Biosynthesis of Farrerol in Pichia pastoris》的研究论文,从兴安杜鹃中鉴定了一个双C-甲基转移酶RdCMT,解析其冷冻电镜结构,并在毕赤酵母中建立了杜鹃素的从头合成途径。

甲基化修饰是药物设计与优化中最常用的后修饰手段之一。甲基转移酶催化的甲基化修饰在植物次生代谢途径中也较为常见。例如,参与黄酮和生物碱类化合物生物合成途径的O-甲基转移酶和N-甲基转移酶等。但是,植物中可催化芳香环发生C-甲基化的C-甲基转移酶(CMT)未见报道。中药满山红是珍稀植物兴安杜鹃的干燥叶,用于止咳祛痰。杜鹃素是满山红的主要活性成分,其结构为6,8-双碳甲基柚皮素。这表明,兴安杜鹃中可能存在功能新颖的C-甲基转移酶。
该研究从兴安杜鹃中挖掘鉴定获得一个双C-甲基转移酶RdCMT,RdCMT可催化柚皮素查耳酮,而非柚皮素,发生连续两步的C-糖基化反应,并通过自发的环化,生成杜鹃素。为了进一步验证RdCMT的催化功能,将RdCMT及黄酮合成通路的相关基因在烟草中瞬时表达,实现了杜鹃素和8-去甲杜鹃素的从头合成。RdCMT是目前报道的第一个黄酮C-甲基转移酶。底物谱考察表明,RdCMT对于查耳酮类化合物具有严格的底物选择性。此外,结合其他后修饰酶,实现了多种新颖C-甲基化黄酮化合物的催化合成。

图1. RdCMT的功能表征
为阐明其催化机制,利用冷冻电镜完成了RdCMT的结构解析,获得了分辨率为3.5Å的蛋白结构。通过结构分析、分子对接和定点突变,推测C-甲基化的催化机制与C-糖基化类似,由His299-Glu357形成的催化二联体,经过脱质子和SN2亲核取代反应完成。此外,还发现R328和G296位点对RdCMT的底物选择性具有重要影响。
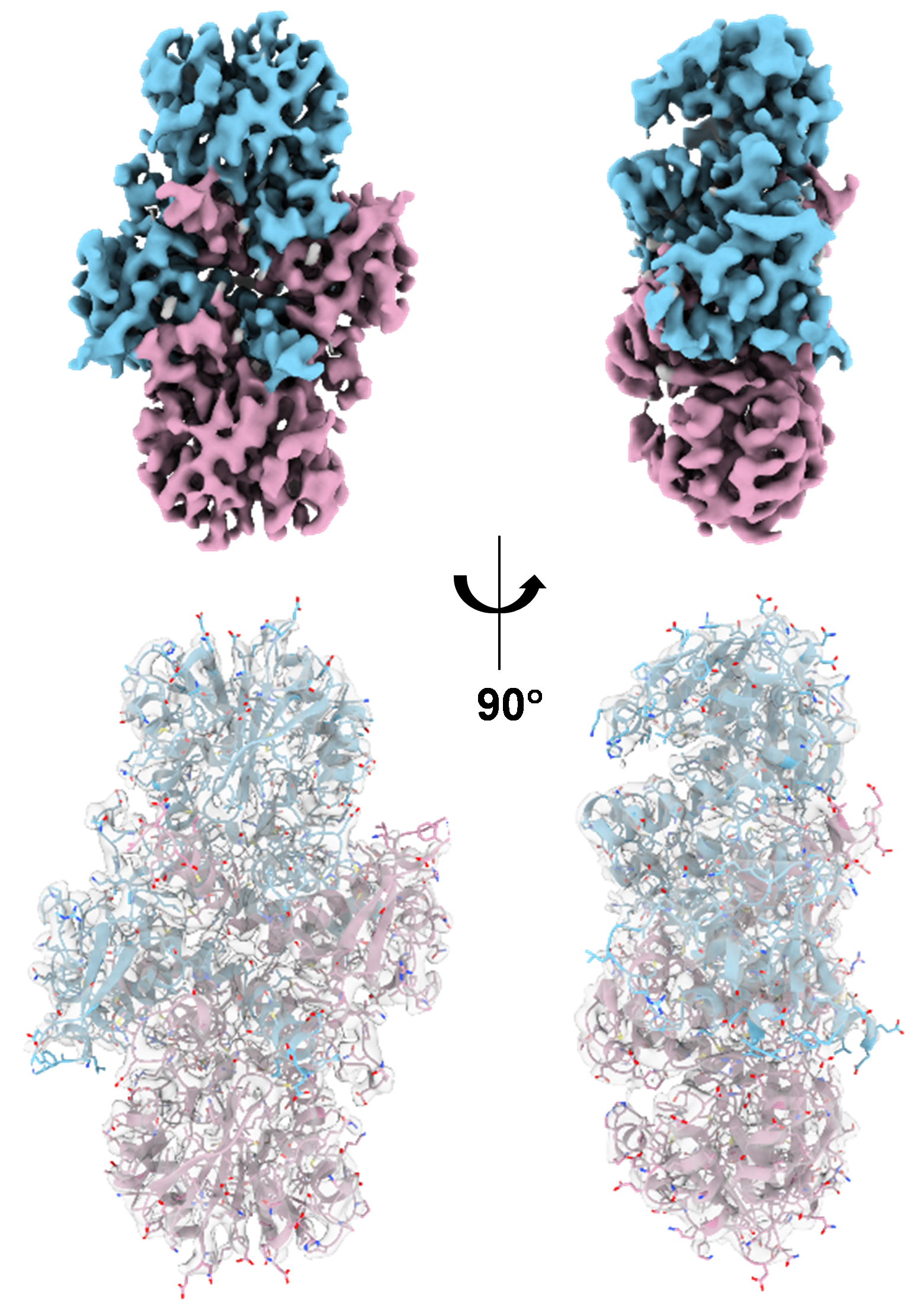
图2. RdCMT的冷冻电镜结构
同时,为了提供杜鹃素及其衍生物的高效获取途径,将RdCMT及杜鹃素合成通路相关基因整合至毕赤酵母染色体,构建菌株TA-CCC,实现了杜鹃素的从头合成,产量为24.0 mg/L。随后,通过一系列优化,获得菌株TA-CC2C2(包括2个RdCMT基因拷贝,2个SbCHS2基因拷贝),其产量为62.6 mg/L。TA-CC2C2菌株在3L发酵罐中的产量最终达到了149.0 mg/L。此外,通过将黄酮合酶基因构建至TA-CC2C2菌株中,实现了其衍生物6,8-二甲基芹菜素的全合成,产量为6.5 mg/L。
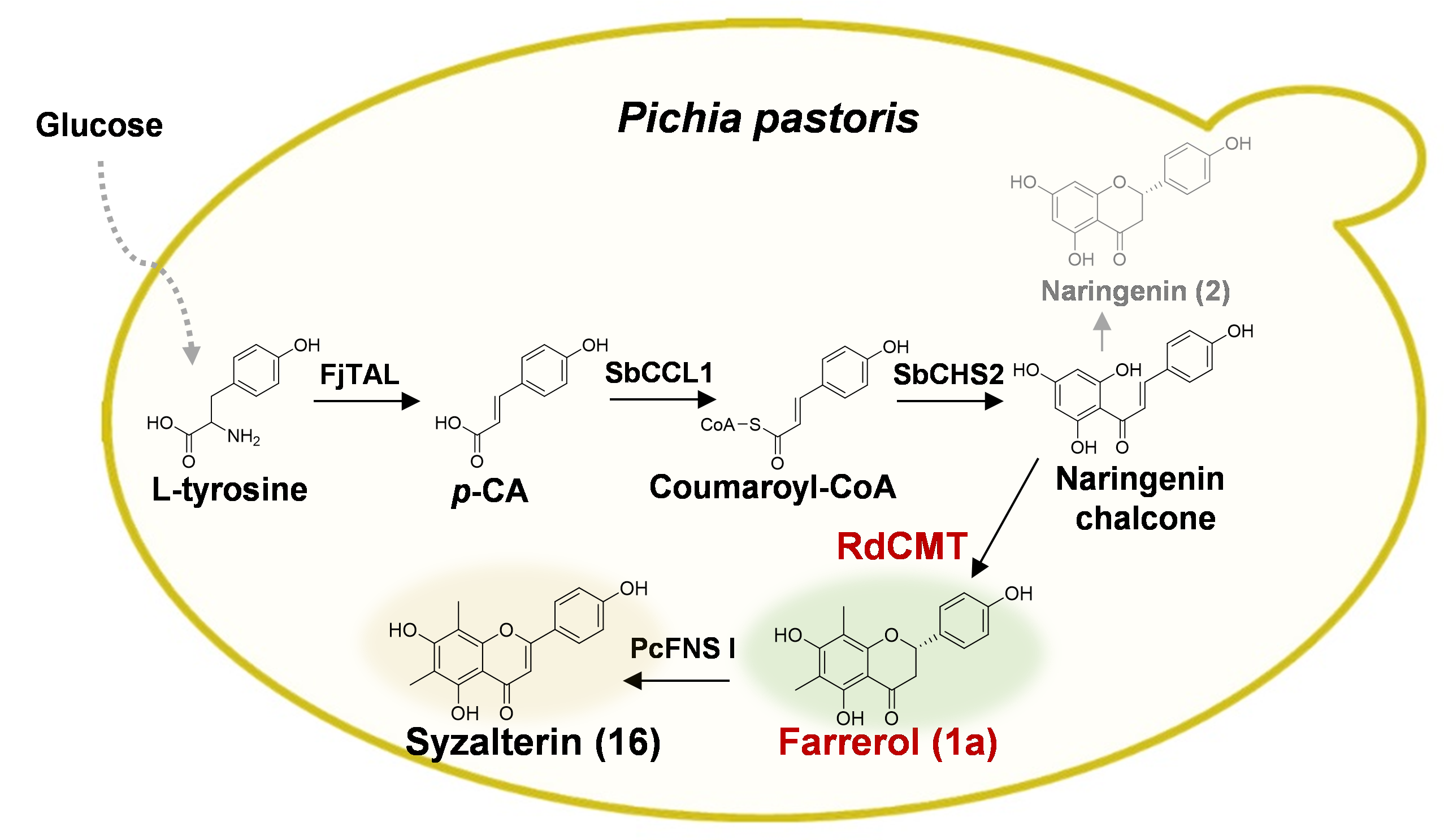
图3. 杜鹃素及其衍生物的异源全合成
北京大学药学院、天然药物及仿生药物全国重点实验室叶敏教授、华东理工大学生物工程学院蔡孟浩教授为论文的共同通讯作者。北京大学药学院博士后张梦、博士研究生鲍杨讴捷、北京大学基础医学院博士后戴宗林为论文的共同第一作者。研究工作得到国家重点研发计划、国家自然科学基金、博士后基金等项目的支持。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.5c02654
第一作者简介:

张梦,北京大学药学院博士后,研究方向为药用植物活性成分的生物合成。以第一作者及共同第一作者在JACS、ACIE等杂志发表SCI论文10篇。

鲍杨讴捷,北京大学药学院2023级博士研究生,研究方向为药用植物活性成分的生物合成。以第一作者及共同第一作者在JACS、ACS Catal等杂志发表SCI论文4篇。
通讯作者简介:

叶敏,北京大学药学院院长,教授,博士生导师。主要从事中药药效物质及其生物合成研究,迄今发表SCI论文260篇,总被引10,088次,H-index为55。目前主持国家重点研发计划“合成生物学”重点专项项目及基金委重点项目。
北京大学药学院