
2025年12月23日和27日,北京大学药学院药剂学系齐宪荣教授团队连续在Nature Communications(IF = 15.7)发表了题为“Leveraging engineered mitochondria through intercellular communication network for accelerated transport and delivery”和Acta Biomaterialia(IF = 9.6)发表了题为“Mitochondrial transfer through tunneling nanotubes inspires an innovative strategy for intercellular drug delivery”的系列研究论文,构建“线粒体自主驱动”系统,开发了一种创新的药物递送策略,借助隧道纳米管实现线粒体介导的深层药物递送与肿瘤治疗。


药物递送系统面临着诸多挑战。恶性肿瘤的治疗效果常受限于药物在肿瘤组织中的渗透性差、递送效率低等瓶颈。传统的纳米药物递送系统虽经多重功能化设计,但仍难以突破多种生理屏障,外源载体易被单核细胞系统清除,影响靶向效率,导致药物在肿瘤深处的富集不足,疗效受限。因此,研究者开始探索利用生物材料(如细胞、细胞外囊泡和细胞器)作为药物递送载体,以提高生物相容性、靶向性和递送效率。然而,大多数策略仅关注细胞外传递路径,而忽略了细胞内运输途径的潜力。
齐宪荣教授团队长期致力于新型药物递送系统的研究开发工作。在前期研究中,我们发现携带药物的小胶质细胞通过细胞外囊泡和隧道纳米管(tunneling nanotubes, TNTs)运输,增强了药物对脑胶质瘤的治疗作用[1],活性氧簇促进了隧道纳米管的形成,增强了深部肿瘤中药物的发散性网络运输[2]。这些发现提示我们,利用生物体细胞间的交流运输机制也许能为外源性药物的递送提供全新的递送策略。
“Mitochondrial transfer through tunneling nanotubes inspires an innovative strategy for intercellular drug delivery”的研究,首先验证了氧化应激在刺激TNTs形成和线粒体转移中的关键作用,通过实验发现氧化应激能够显著增强TNTs的形成和线粒体的双向运输。研究者利用光敏剂IR780,将其与线粒体结合(IR780/Mito),并通过近红外光(NIR)调节TNTs的动态变化。实验中,温和的NIR照射能够促进TNTs的形成和IR780/Mito的转移,而高强度的NIR照射则会破坏TNTs,阻断药物运输。此外,研究还通过共培养模型和肿瘤球体模型验证了TNTs介导的药物传递效率和组织穿透能力。实验结果表明,氧化应激能够显著增强TNTs的形成和线粒体的转移,且这种现象在多种肿瘤细胞系中均得到验证。通过共培养模型,研究者观察到健康细胞能够向受损细胞转移功能性线粒体,而受损细胞则向健康细胞传递损伤信号。此外,IR780/Mito能够通过TNTs在细胞间有效传递,并在肿瘤球体模型中实现深度组织穿透。通过NIR光的调节,实现了对TNTs动态变化的精确控制,从而为药物递送提供了一种可控的细胞内运输途径。这些发现为利用TNTs进行精准药物递送提供了新的思路。
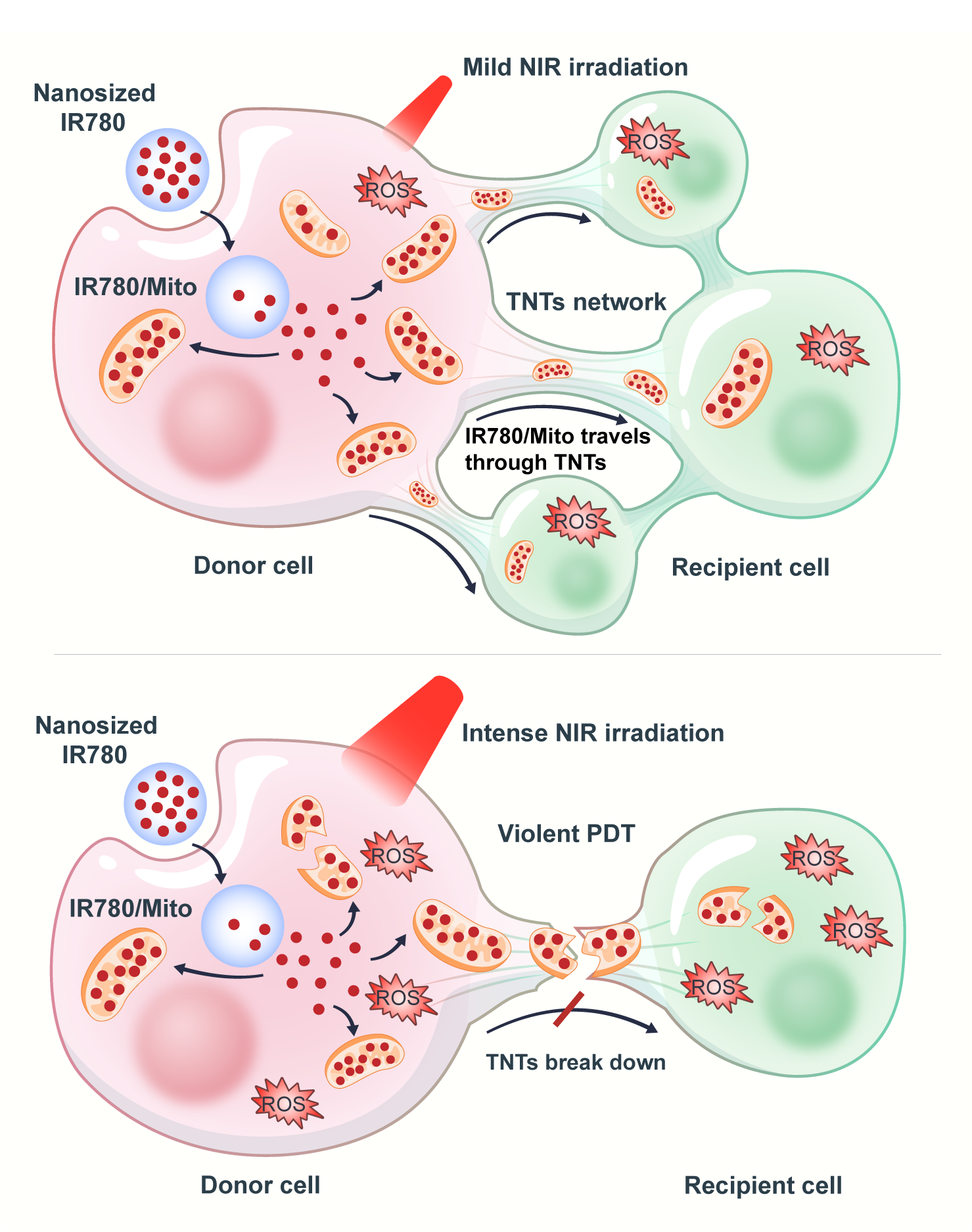
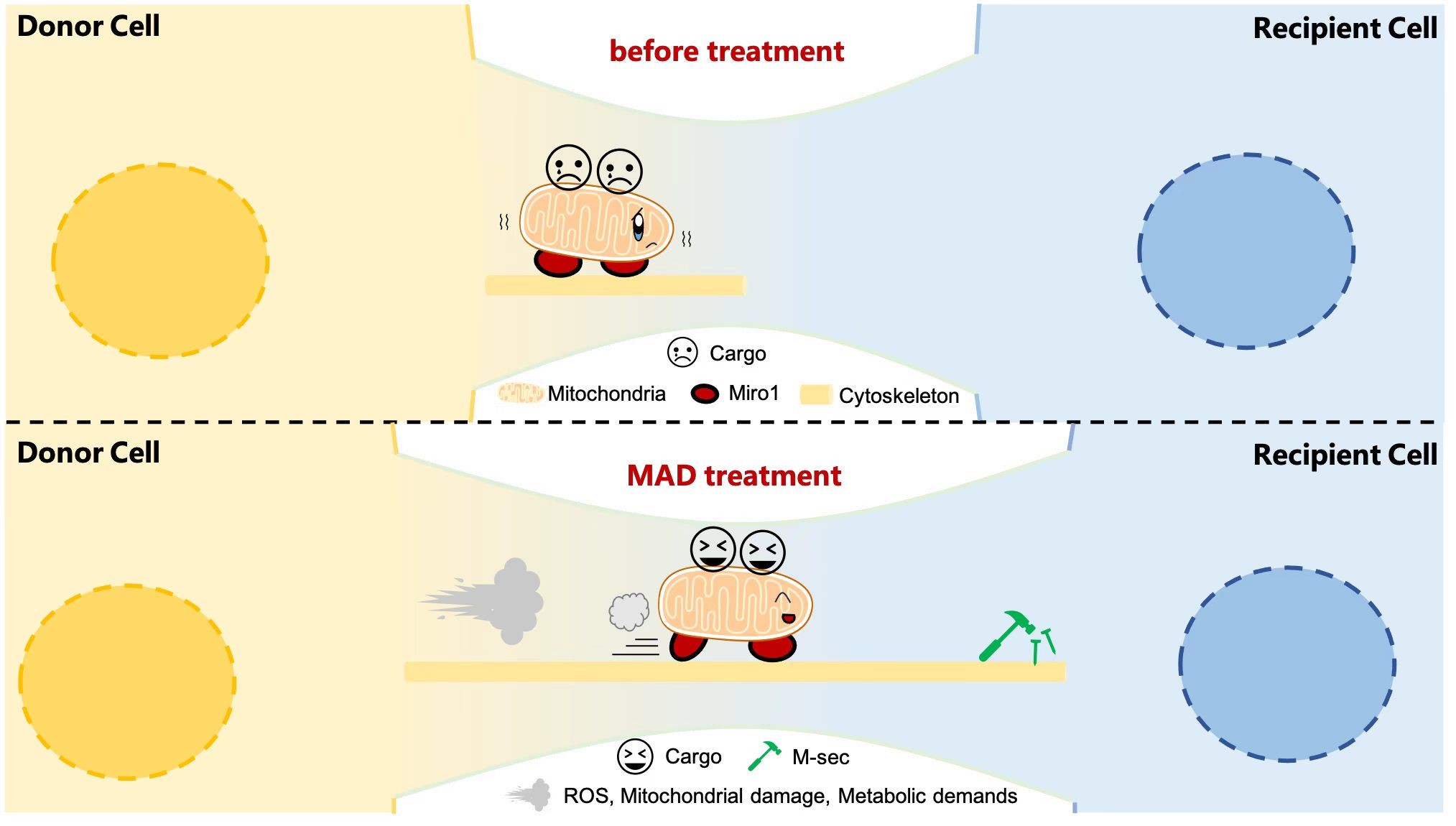
进而,受线粒体在细胞间通讯中的非跨膜转移的启发,研究者进行了一项加速线粒体细胞间运输的原始探索(Leveraging engineered mitochondria through intercellular communication network for accelerated transport and delivery),并将其应用于外源性货物运输。本研究发现,通过CRISPR/Cas9技术或siRNA敲低关键线粒体自噬基因PINK1,能够显著抑制线粒体自噬,从而触发一系列代偿反应,为线粒体高速传输奠定基础。首先,抑制线粒体自噬增加了细胞间隧道纳米管(TNTs)的数量,这为线粒体的胞间运输构建了高效的“交通网络”。进一步,这种调控深刻改变了细胞代谢状态,使线粒体氧化磷酸化(OXPHOS)能力显著增强,为后续的远程运输提供了充沛的能量驱动力。与此同时,线粒体从相互连接的管状网络解离,更多地转变为更易移动的圆形个体,其自身的运动能力也获得了显著提升,从而为药物递送提供了更多可搭乘的“车辆”。
研究团队构建了线粒体自主驱动(Mitochondrial Autonomous Drive, MAD)系统。该系统包含两部分:一是用于敲低PINK1的CRISPR/Cas9基因编辑纳米复合物(FP);二是负载了线粒体靶向光敏剂IR780和超顺磁性氧化铁纳米粒(SPION)的纳米粒(FIS)。SPION能在亚毒性浓度下产生持续的氧化应激,进一步“点燃”线粒体的迁移动力。研究证实,经MAD系统处理的肿瘤细胞,其线粒体细胞间转移水平显著提升。更重要的是,附着在线粒体上的“乘客”——IR780,能够同步、高效地随线粒体在细胞网络间穿梭。当特异性抑制TNTs形成(如细胞松弛素D)或线粒体运动关键蛋白(如M-sec/Miro-1)表达时,线粒体及IR780的胞间转移均被阻断,证明了TNTs介导的线粒体搭载递送是MAD系统的核心机制。
MAD系统展现出对药物递送与疗效的“开关”控制能力。在无近红外光(NIR)照射时,MAD主要促进药物在肿瘤深部的渗透与分布;而一旦施加NIR照射,富集于肿瘤各处的IR780会产生大量活性氧(ROS),引发强烈的光动力治疗(PDT)效应,同时导致作为“运输通道”的TNTs瓦解,切断肿瘤细胞的潜在“救援”通路,实现“先利用,后摧毁”的智能治疗效果。在B16F10黑色素瘤小鼠模型中,MAD联合NIR照射的治疗方案展现了卓越的抗肿瘤效果。经过三个周期的治疗,接受“MAD+NIR(++)”方案的小鼠有43%实现了肿瘤完全消退,且显著抑制了肿瘤增殖、促进了细胞凋亡,并伴有线粒体自噬抑制及线粒体运动激活效应。整个治疗过程中小鼠体重及主要器官未出现明显异常,表明该系统具有良好的安全性。
让药物搭载线粒体驶上“高速路”
本研究创新性地提出利用线粒体作为药物载体,通过TNTs实现细胞间的药物运输,从而实现高效的细胞间药物递送。这种策略不仅提高了药物的运输效率,还避免了传统纳米载体可能带来的免疫反应和清除问题。利用光敏剂IR780和近红外光(NIR)实现了对TNTs动态变化的精确调控。通过调节NIR光的强度,能够实现TNTs的形成和断裂,从而控制药物的传递过程。这种光调控策略为药物递送提供了一种可控的、非侵入性的手段,能够在需要时精确地启动或停止药物传递,提高了药物递送的精准性和安全性。首次在活体肿瘤组织切片中直接观察到连接两个细胞的TNTs结构,并与IR780荧光存在强烈重叠,为细胞间通讯机制提供证据。首次系统揭示了通过调控线粒体自噬可以主动增强线粒体胞间传输能力。构建高速交通网络,生产药物可搭乘的“线粒体车辆”,并为其赋能。将这一生物学过程转化为一种普适性的药物递送新平台。MAD系统创新性地利用了肿瘤细胞自身的细胞器(线粒体)和通讯网络(TNTs)作为药物载体与通道,为克服肿瘤药物递送屏障提供了全新的思路。这项工作不仅为光动力治疗,也为其他需要突破生物屏障的疗法(如化疗、基因治疗、免疫治疗等)带来了广阔的应用前景。未来,通过为该系统装配肿瘤归巢配体,有望实现更精准的靶向递送,进一步推动其临床转化。
博士研究生杜祎甜为Acta Biomaterialia的第一作者,彭祎玮和高达同为Nature Communications的第一作者。齐宪荣为通讯作者。研究得到国家自然科学基金的资助。
作者简介:

齐宪荣,北京大学药学院长聘教授。主要研究领域为先进药物递送技术,纳米技术与生物技术。
论文链接:
https://www.nature.com/articles/s41467-025-67837-8
https://pubmed.ncbi.nlm.nih.gov/41461218
参考文献:
[1] Engineered Microglia Potentiate the Action of Drugs against Glioma Through Extracellular Vesicles and Tunneling Nanotubes. Adv. Healthcare Mater. 2021, 10, 2002200.
[2] Hierarchical self-recognition and response in CSC and non-CSC micro-niches for cancer therapy. Biomaterials. 2024, 308, 122581.
北京大学药学院 药剂学系