
2024年10月30日,我院天然药物及仿生药物全国重点实验室王坚成团队和中日友好医院代华平团队在国际著名期刊Advanced Science在线刊登了基于调控线粒体开放改善特发性肺纤维化治疗的最新研究成果“Double Braking Effects of Nanomedicine on Mitochondrial Permeability Transition Pore for Treating Idiopathic Pulmonary Fibrosis”(纳米粒子对线粒体通透性转换孔的“双刹”效应治疗特发性肺纤维化)。

特发性肺纤维化(IPF)是一种进展性、致死性纤维化间质性肺疾病,中位生存期为2-3年。病理表现为正常肺组织被过量的间质细胞和细胞外基质取代,肺泡结构被破坏,代之以肺泡区域致密纤维化。随着人口老龄化,世界范围内的IPF发病率逐年增加。据世界IPF联合协会统计,每年约有122万新发IPF患者。目前,吡非尼酮(Pirfenidone,PFD)和尼达尼布是经FDA批准的IPF治疗药物。然而,这些药物仍存在高临床剂量、耐药性和副作用大等缺点。因此,亟需开发新型的IPF治疗策略。
IPF的发病机制与II型肺泡上皮细胞(AECIIs)的反复微损伤相关。受损和功能失调的AECIIs经历上皮间充质转化(EMT)过程,导致过度的细胞外基质沉积以及成纤维细胞的活化。线粒体功能异常是AECIIs损伤的关键标志,其特征为mPTP开放、ΔΨm水平降低和DAMPs释放。线粒体通透性转换孔(mPTP)是一种非特异性的、电压依赖性的复杂孔道,由位于线粒体内膜的多种蛋白质组成。它的结构主要由亲环蛋白D(CypD)、腺嘌呤核苷酸转移酶(ANT)和电压依赖离子通道(VDAC)组成。在正常生理条件下,线粒体内膜仅对有限数量的代谢物和离子具有渗透性。然而,在衰老、氧化应激和Ca2+超载等病理条件下,CypD从线粒体基质转位到线粒体内膜上,然后与ANT结合促进VDAC和ANT组成通道样结构。环孢菌素A(CsA)可以通过结合线粒体内膜中的CypD来抑制其与ANT的结合,进而抑制mPTP开放。CsA通过调节线粒体功能异常在多种疾病中均表现出良好的治疗效果。因此,利用CsA结合CypD抑制AECIIs损伤中mPTP开放可能为IPF提供一种潜在的治疗策略。此外,mtCa2+的转运过程由位于线粒体内膜的线粒体钙单向转运蛋白(MCU)复合物调节。在正常生理条件下,MCU可将Ca2+从细胞质中转运至线粒体基质,激活Ca2+依赖性三羧酸(TCA)循环脱氢酶,以促进线粒体三磷酸腺苷(ATP)的产生和支持细胞能量需求。然而,MCU过表达可诱导mtCa2+过度积累,进而触发mPTP开放,最终导致细胞损伤和凋亡。因此,调控线粒体Ca2+(mtCa2+)转运为抑制mPTP开放提供了另一种新策略。
在本研究中,我们提出基于结合CypD蛋白和下调MCU蛋白表达对线粒体mPTP开放的双重抑制新策略(“双刹”效应),协同改善AECIIs的线粒体功能障碍和抑制EMT过程,进而缓解IPF进展。我们首次证明MCU在IPF患者肺组织AECIIs中过表达,可作为治疗IPF的潜在新靶点。此外,我们设计构建了一种由可电离头(叔胺)、柔性尾链(脂肪链)和刚性环(CsA)组成的新型具有三维结构的可电离脂质材料(3D脂质)。如图1所示,使用微流控芯片将3D脂质与siMCU以及辅助脂材共组装形成一体化纳米制剂3D-LNP/siMCU NPs,用于IPF的疗效评价。该纳米制剂能够通过CsA结合CypD和siRNA下调MCU表达,协同抑制mPTP开放,进而缓解线粒体功能异常,以保护AECIIs免受细胞损伤,并且抑制其EMT过程。在博来霉素(BLM)诱导肺纤维化小鼠模型中,3D-LNP/siMCU NPs显著抑制了肺组织中胶原沉积、促纤维化因子表达和AECIIs的EMT过程,且其体内疗效在肺组织I型胶原蛋白(Col-I)表达水平、羟脯氨酸(HYP)含量和转化生长因子-β(TGF-β)表达水平等多药效指标上优于已上市的临床治疗药物PFD。此外,我们将3D脂质作为第5组分掺入组合到以商用脂质Dlin-MC3-DMA为基质的递送载体系统(MC3/siRNA NPs)中,以获得优化的Opt-MC3/siMCU NPs。与MC3/siRNA NPs相比,该优化的Opt-MC3/siMCU NPs制剂表现出显著增强了肺部雾化给药稳定性、更优的基因沉默效率和更佳的抗肺纤维化治疗效果。这种针对线粒体mPTP开放“双刹”策略为IPF患者的临床治疗提供了一种潜在的新手段。
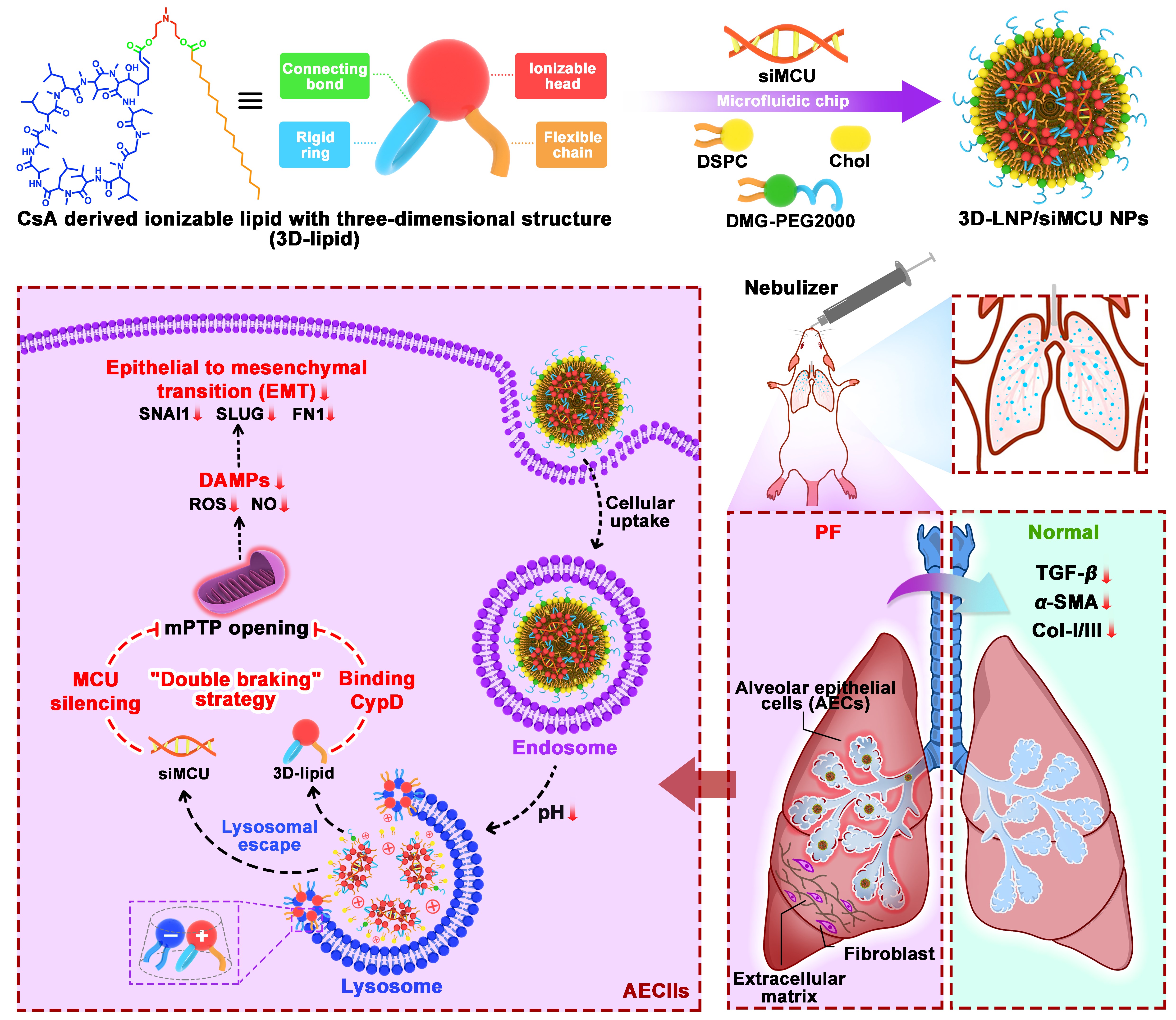
图1. 环孢菌素A(CsA)衍生的具有三维结构的可电离脂质(3D脂质)能够辅助靶向线粒体钙单向转运蛋白(MCU)的siRNA(siMCU)肺部递送治疗特发性肺纤维化(IPF)。基于3D脂质和siMCU的LNPs可以通过结合CypD和下调MCU表达协同抑制mPTP开放和损伤相关分子模式(DAMPs)的释放,进而缓解AECII的线粒体功能异常以及抑制EMT过程。

左起:卢安博士、徐之艺、赵志霞博士、闫仪博士
北京大学药学院王坚成教授和中日友好医院呼吸中心代华平教授为本文的共同通讯作者。2020级博士研究生卢安、2020级长学制徐之艺、中日友好医院药师赵志霞和北京大学博士后闫仪博士为本文的共同第一作者。团队成员姜临霞、王向宇、耿菁老师、金宏威老师、刘晓岩老师、朱元军老师、石玉杰老师、刘丽宏老师为该研究做出了重要贡献。天然药物及仿生药物全国重点实验室仪器平台和北京大学医学部医药卫生分析中心的各位老师为该研究提供了重要帮助。北京大学药学院天然药物及仿生药物全国重点实验室为第一单位。该项研究得到国家重点研发计划项目、国家自然科学基金、宁波市科技计划项目、北京大学优秀人才及中国医学科学院创新工程等项目的支持。
论文链接:https://doi.org/10.1002/advs.202405406
通讯作者简介:

王坚成,北京大学博雅特聘教授,药学院药剂学系博士生导师,天然药物及仿生药物全国重点实验室PI,教育部长江学者特聘教授,科技部中青年科技创新领军人才、教育部新世纪优秀人才。现任北京大学科研部副部长兼医学部科研处处长,北京大学宁波海洋药物研究院副院长,中国药学会核酸药物专业委员会副主任委员,中国药学会药剂专业委员会委员,北京药学会药剂专业委员会主任委员。长期关注生物大分子给药系统研究,尤其是核酸药物递送系统的创新研究。已在Nat Communication、ACS Nano、Adv Science、Biomaterials、J Control Release等国际权威学术杂志发表高水平论文100余篇,获新药证书1项,临床批件2件,主编教材《现代药剂学》、主译书籍《纳米粒药物输送系统》。主持承担siRNA递送相关研究的国家自然科学基金5项,主持国家重点研发计划项目、国家重大新药创制研发技术平台等国家级和省部级项目5项。

代华平,教授、主任医师。北京协和医学院博士生导师、首都医科大学博士生导师。现任中日友好医院呼吸中心副主任、内科教研室主任。主要研究方向:间质性肺疾病(包括间质性肺炎/肺纤维化、结节病)、呼吸疑难杂症等。任中华医学会呼吸学会常务委员、间质性肺疾病(ILD)学组组长,中国呼吸医师协会常委兼总干事,《国际呼吸杂志》、《中国临床医生杂志》副主编,Chin Med J、Curr Med Sci、《中华结核和呼吸杂志》编委等。主持“十三五”“十四五”国家重点研发计划专项、国家自然科学基金重大研究计划培育项目、国家自然科学基金面上项目等多项。作为主要完成者之一,获批专利5项,获卫生部科技进步一等奖、北京市科学技术奖二等奖各1项。以第一或责任作者在Eur Respir J、Thorax、Chest、Cell Research、中华医学杂志等国内外著名学术刊物发表论文100余篇。
天然药物及仿生药物全国重点实验室