
2021年10月21日,北京大学药学院天然药物及仿生药物国家重点实验室张强、何冰团队以Article形式在纳米领域国际权威期刊《ACS Nano》发表了有关纳米药物转运机制的最新研究成果。论文题目是:纳米-蛋白相互作用网络揭示金纳米粒跨上皮细胞的转运路径及其与Wnt/β-catenin 信号的相关性(Nanoprotein interaction atlas reveals the transport pathway of gold nanoparticles across epithelium and its association with Wnt/β-catenin signaling)。

纳米技术已经广泛应用于药物的研究与开发。相比于传统药物制剂,纳米药物能够显著提升药物的溶出、吸收并改变药物分子原有的体内分布和靶向特征,增强治疗功效。药物在其递送过程中会受到机体内大量不同蛋白分子的影响,微观尺度上的纳米-蛋白相互作用不仅介导药物递送过程而且会影响纳米用药安全。因此,在分子层面阐明该相互作用机制具有十分重要的意义与价值。该研究以不同粒径的金纳米粒作为纳米药物模型,探索制剂在跨上皮细胞转运过程中的纳米-蛋白相互作用机制。研究引入了纳米系统生物学策略,通过同时提取、分析并鉴定纳米粒在跨上皮细胞转运过程中形成的颗粒表面花冠蛋白吸附以及纳米转运过程诱导的细胞蛋白表达变化,建立并绘制了同时基于直接和间接相互作用的纳米-蛋白相互作用网络。该研究揭示了内吞囊泡/内质网/高尔基体/分泌囊泡通路在纳米粒跨膜转运过程中的主导作用;同时,研究发现了纳米转运和Wnt/β-catenin 信号通路的相关性:不同粒径的纳米粒差异化的诱导Wnt/β-catenin 信号的激活;Wnt信号通路反过来也通过外泌体调控纳米粒的细胞转运过程。该研究在分子水平上阐释了当前研发过程中大粒径纳米粒跨上皮细胞吸收及转运效率低的原因,为纳米药物跨上皮屏障研究提供了一种新的调控策略,并为口服药物递送提供了新思路。该研究得到了国家自然科学基金重大项目等的支持。
北京大学药学院2016级硕士研究生张箭为论文第一作者,张强教授和何冰副研究员为共同通讯作者。
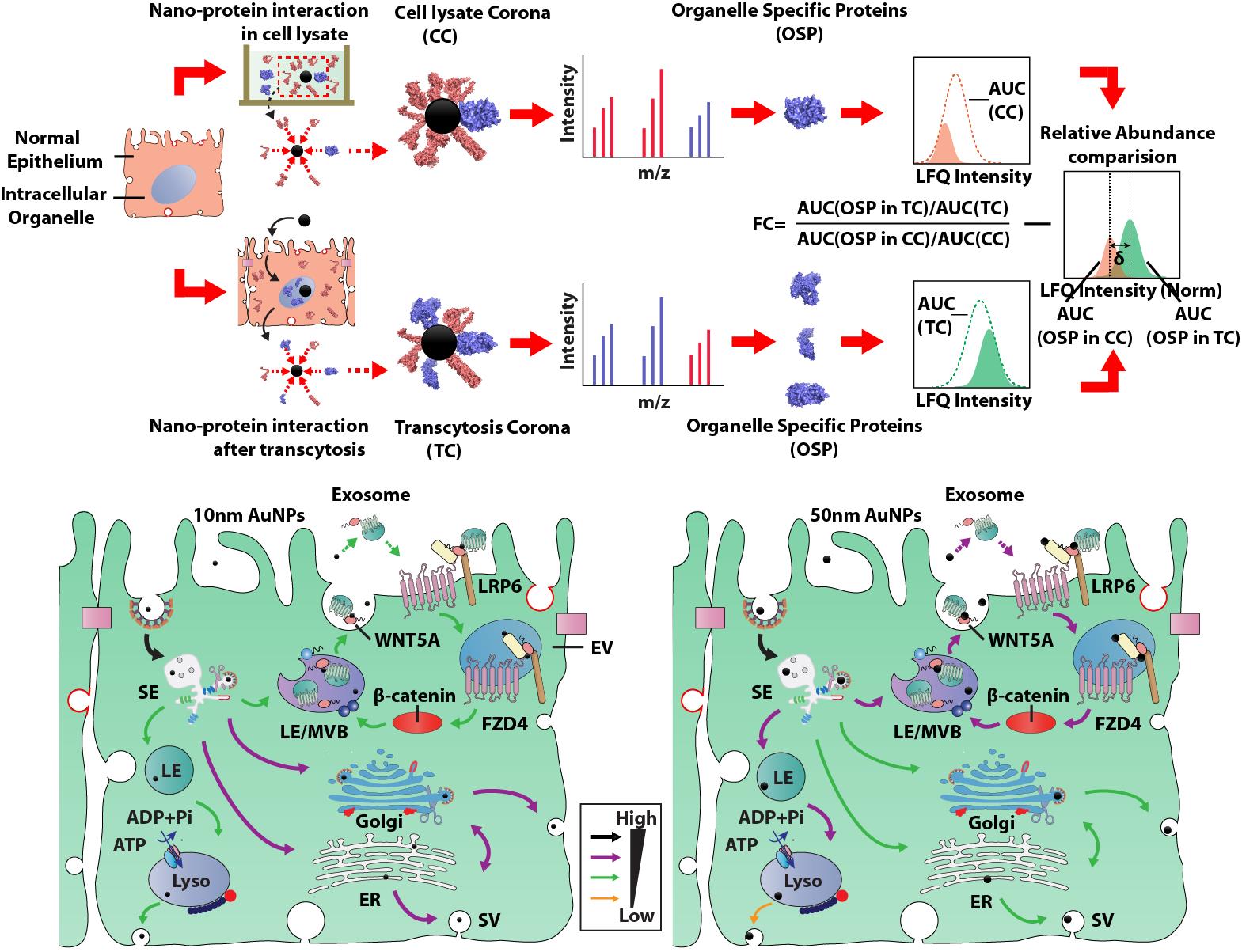
利用纳米系统生物学策略构建跨上皮细胞转运过程中的纳米-蛋白相互作用网络
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.1c06452
通讯作者简介

张强,北京大学药学院教授,博士生导师。张强教授系北京大学博雅特聘教授,分子药剂学与新释药系统北京市重点实验室主任,教育部创新团队负责人,中国药学会常务理事,中国药学会纳米药物专业委员会副主任委员,国家药典委药制专业委员会副主任,Acta Pharm. Sinica B副主编,Adv. Drug Deliver. Rev.和 J. Control. Release编委等。长期从事纳米药物研究,在Nat. Commun.、J. Extracellular Vesicles、Adv. Funct. Mater.、Nano Today、ACS Nano.、Nano Lett.、Adv. Drug Deliver. Rev.、Biomaterials、J. Control. Release等发表300多篇SCI论文。负责完成创新制剂研究30余项,申请国内外发明专利50多项,开发上市多个新型释药系统,产生重大经济与社会效益。获国家与省部级科技成果奖多项。

何冰,北京大学药学院副研究员,博士生导师。主要研究领域:纳米生物学与分子药剂学,包括纳米材料与机体(细胞)相互作用的分子调控机制,纳米载体细胞转运的信号调控网络等。以第一或通讯作者在Adv. Drug Deliver. Rev.、Nat. Commun.、Nano Today、ACS Nano、Biomaterials、Theranostics、Nanoscale、ACS Applied Materials & Interfaces等权威期刊上发表研究论文多篇。目前承担1项国家自然科学基金项目,参加了国家973计划等多项研究课题。在国内外较早开始从纳米生物学角度开展纳米药物载体跨细胞转运机制的研究工作,阐明了一系列纳米药物特有的转运通路及调控规律,相关研究被国外专家评价为领域内“里程碑式的研究”。近年来又率先将多组学技术应用于该领域,在国内外提出了纳米系统生物学的概念与策略,在基于分子层面的纳米-机体相互作用方面取得了诸多新发现,阐明了之前多被忽略的内质网-高尔基体途径在纳米药物转运及功效发挥中的关键作用,逐步建立了具有自身特色的纳米药物评价体系。
北京大学药学院 天然药物及仿生药物国家重点实验室 供稿