
2023年9月25日,我院天然药物及仿生药物全国重点实验室叶敏/乔雪研究团队在国际著名期刊Nature Communications上在线发表研究论文“Characterization and structure-based protein engineering of a regiospecific saponin acetyltransferase from Astragalus membranaceus”,进一步完善了黄芪皂苷生物合成的下游途径。

皂苷是分布广泛、结构复杂、活性多样的天然产物,常含有酰基化修饰。酰基化可以提升皂苷的生物活性,是药物结构修饰的重要手段。由于糖上不同羟基的化学环境相似,采用化学法定点酰基化修饰相对困难,寻找高效的生物催化元件十分必要。酰基化反应多由酰基转移酶催化,皂苷酰基转移酶数量极少,相似度低,发现新的催化元件存在困难,而中药黄芪含有大量的酰基化皂苷,是发掘新颖催化元件的适宜材料。
该研究采用“分步BLAST”法,从膜荚黄芪(Astragalus membranaceus)中发现了第一例四环三萜皂苷酰基转移酶AmAT7-3,与已知的糖苷酰基转移酶序列有明显差异。AmAT7-3可催化黄芪皂苷木糖的3'和4'位发生乙酰化,生成多种黄芪皂苷。
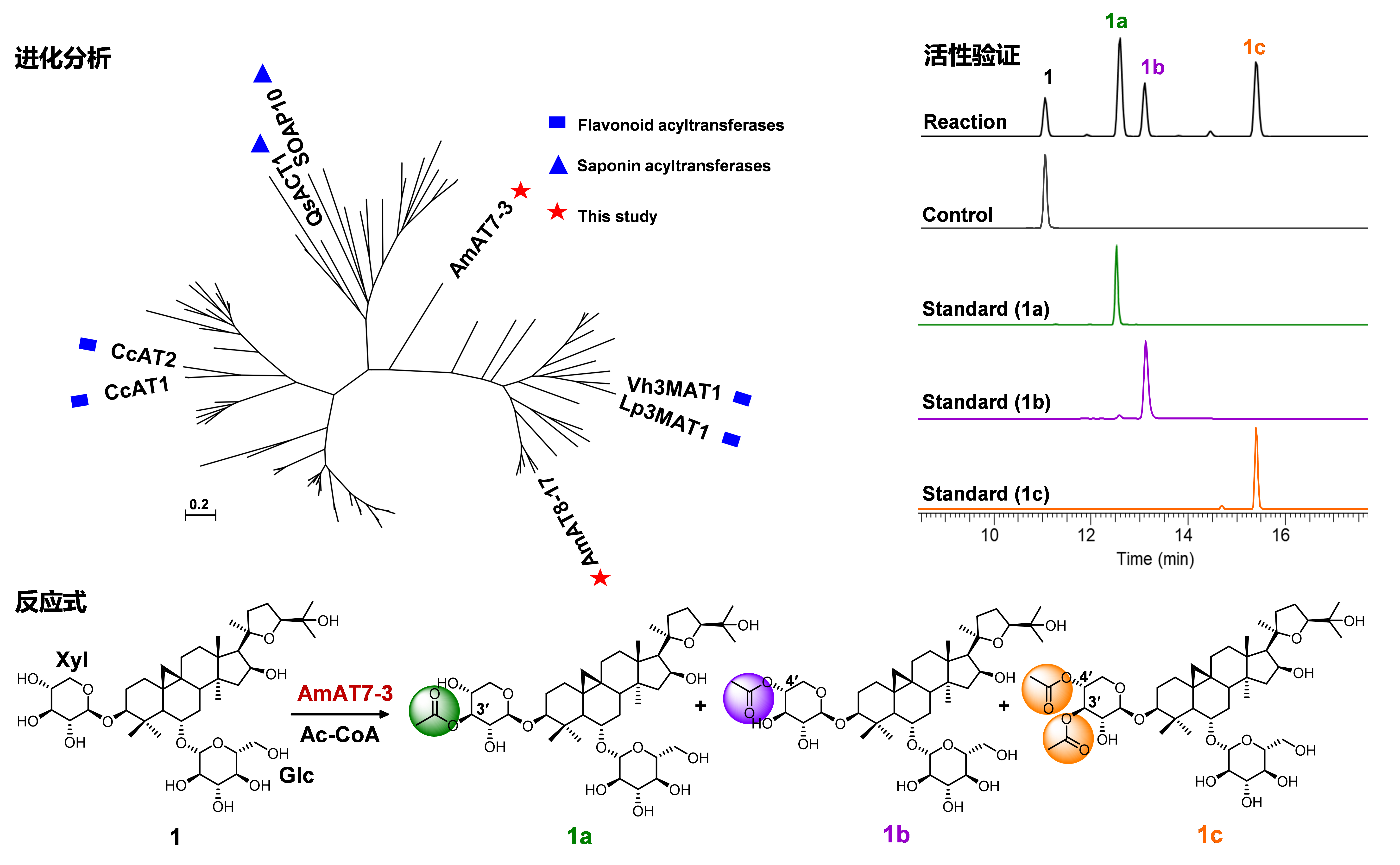
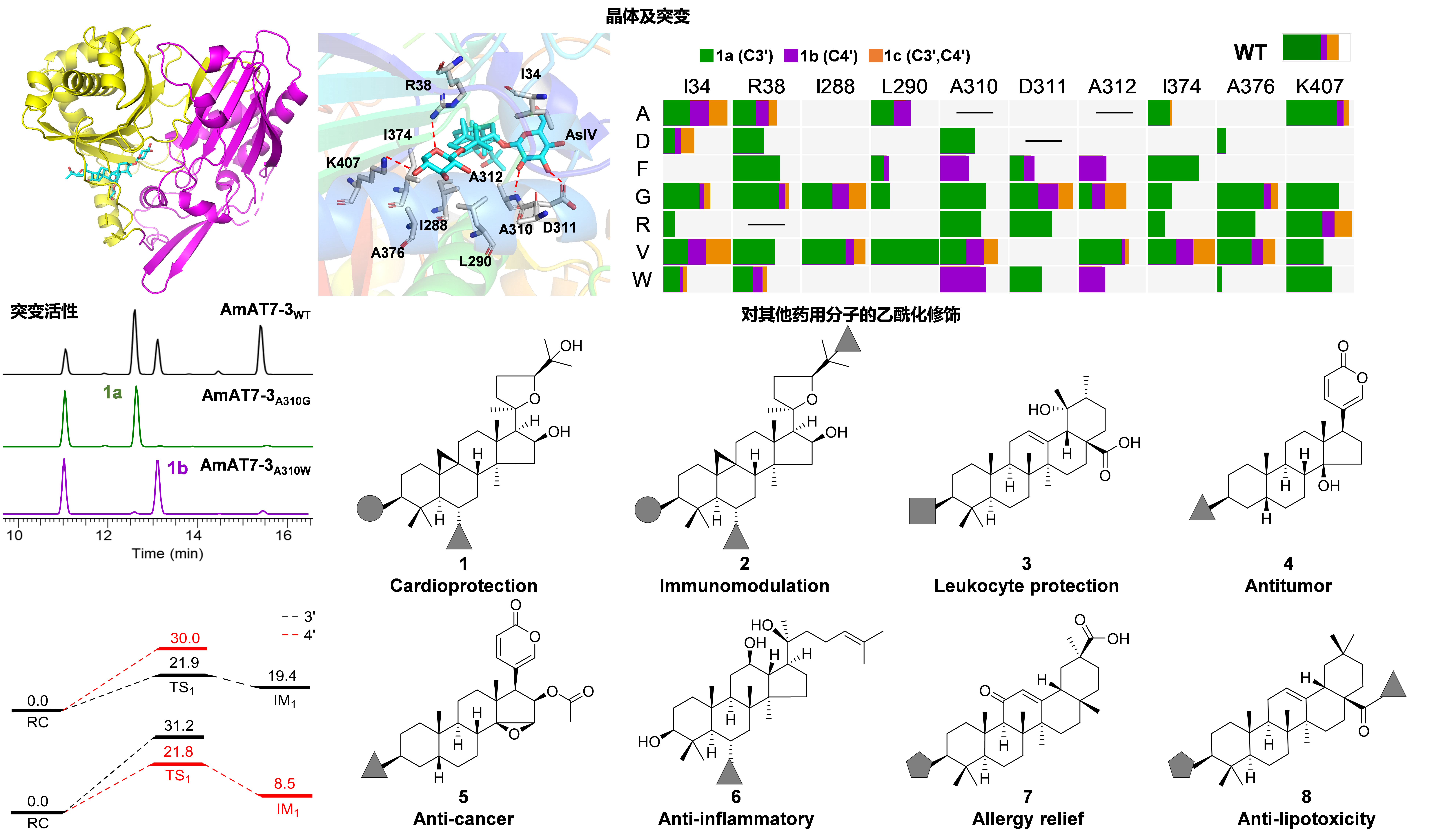
经多次尝试,解析了AmAT7-3和底物黄芪甲苷的共晶结构(PDB: 8H8I, 2.03Å),是第一个三萜酰基转移酶晶体。基于晶体结构及理论化学计算,发现AmAT7-3活性口袋内部的特异性小体积基序AADAG导致其具有很大的活性口袋,使得糖苷键可以在活性口袋内自由旋转形成两种构象,对应生成两个位点的乙酰化产物。同时,对活性口袋内部的氨基酸进行理性设计小型突变体库,成功实现了位点选择的蛋白质功能改造。最后,AmAT7-3及其突变体被应用到多种重要药用活性皂苷分子的乙酰化的定点修饰中。
该研究是叶敏/乔雪团队在黄芪皂苷生物合成途径解析中的系列工作之一。乔雪研究员、叶敏教授、厦门大学王斌举教授为论文的通讯作者。北京大学药学院2022级博士研究生王林林、厦门大学2019级本科生江枝辉、北京大学药学院2021级直博生张嘉贺为论文的共同第一作者。北京大学药学院天然药物及仿生药物全国重点实验室为第一单位。该研究得到国家自然科学基金的大力支持。重点室平台贾红丽、尹富玲老师对晶体衍射实验提供了重要帮助。
论文链接:https://www.nature.com/articles/s41467-023-41599-7
【乔雪研究员简介】

乔雪,北京大学药学院研究员,博雅青年学者,博士生导师。2012年毕业于北京大学药学院,获博士学位,后留校任教,2016-2018年在英国John Innes Centre做访问学者。主要研究领域为中药药效成分及其生物合成,对黄芪皂苷生物合成途径开展了系列研究。在PNAS、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.等期刊发表高水平学术论文90余篇,获批专利10余项。入选国家基金委优青、北京市杰青、中国科协青年人才托举工程等人才计划。
【叶敏教授简介】

叶敏,北京大学药学院教授,博士生导师。入选国家自然科学基金委杰出青年基金、优秀青年基金、教育部新世纪优秀人才、北京市科技新星等人才计划。主要研究领域为中药药效物质、天然产物生物合成与生物催化,关注甘草等常用中药及其活性成分的研究。发表高水平论文200余篇,被引用5000余次,获批专利10项。目前担任J. Ethnopharmacol.、J. Pharm. Biomed. Anal.等杂志的副主编或编委,兼任国家药典委员。
天然药物及仿生药物全国重点实验室 供稿